
题目列表(包括答案和解析)
经检验,某酸雨的成分除含有少量H+和极少量OH-外,还有Na+、Cl-、![]() 、
、![]() 等离子,已知:c(Na+)=7×10-6 mol· L-1,c(Cl-)=3.5×10-5 mol· L-1,c(
等离子,已知:c(Na+)=7×10-6 mol· L-1,c(Cl-)=3.5×10-5 mol· L-1,c(![]() )=2.3×10-5 mol· L-1,c(
)=2.3×10-5 mol· L-1,c(![]() ) =2.5×10-6 mol·L-1,则该酸雨的pH为()
) =2.5×10-6 mol·L-1,则该酸雨的pH为()
A.3 B.4 C.5 D.6
A.3 B.4 C.5 D.6
某酸雨的成分,经检验除含有少量![]() 和极少量
和极少量![]() 外,还有
外,还有![]() 、
、![]() 、
、![]() 、
、![]() 等离子,已知
等离子,已知![]() ,
,![]() ,
,![]() ,
,![]() ,则该酸雨的pH为
,则该酸雨的pH为
A.3
B.4
C.5
D.6
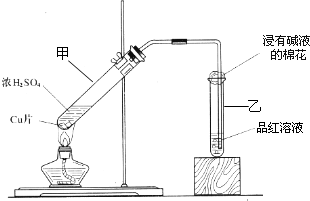 某教师在课堂上用右图所示的装置来验证浓硫酸与铜是否发生反应,并探讨反应所产生气体的性质.请答下列问题:
某教师在课堂上用右图所示的装置来验证浓硫酸与铜是否发生反应,并探讨反应所产生气体的性质.请答下列问题: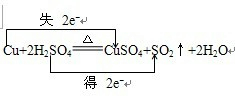

湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com