
题目列表(包括答案和解析)
(06年江苏卷)(8分)氯化亚铜(CuCl)是重要的化工原料。国家标准规定合格的CuCl产品的主要质量指标为CuCl的质量分数大于96.50%。工业上常通过下列反应制备CuCl
2CuSO4+Na2SO3+2NaCl+Na2CO3===2CuCl↓+3Na2SO4+CO2↑
⑴CuCl制备过程中需要配置质量分数为20.0%的CuSO4溶液,试计算配置该溶液所需的CuSO4?5H2O与H2O的质量之比。
⑵准确称取所配置的0.2500g CuCl样品置于一定量的0.5mol?L-1 FeCl3溶液中,待样品完全溶解后,加水20mL,用0.1000mol?L-1的Ce(SO4)2溶液滴定到终点,消耗24.60mLCe(SO4)2溶液。有关反化学反应为
Fe3++CuCl===Fe2++Cu2++Cl-
Ce4++Fe2+===Fe3++Ce3+
通过计算说明上述样品中CuCl的质量分数是否符合标准。
(06年江苏卷)(8分)卤素互化物是指不同卤素原子之间以共价键结合形成的化合物,XX’型卤素互化物与卤素单质结构相似、性质相近。试回答下列问题:
⑴卤素互化物BrCl能发生下列反应
H2O+BrCl===HBrO+HCl
 KBr+BrCl===KCl+Br2
KBr+BrCl===KCl+Br2
①写出KI与IBr反应的化学方程式______________。
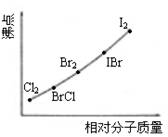
②写出苯与(C6H6)与ICl发生取代反应生成一卤代物的化学方程式____________________________。⑵右图是部分卤素单质和XX’型卤素互化物的沸点与其相对分子质量的关系图。它们的沸点随着相对分子质量的增大而升高,其原因是______________。
⑶试推测ICl的沸点所处的最小范围______________。
(08上海闽行区模拟)(8分)实验室用50mL浓盐酸跟足量的氯酸钾固体共热制取氯气,反应的化学方程式为(未配平):
KClO3 + HCl → KCl + Cl2↑+ H2O
(1)配平上述反应化学方程式:
KClO3 + HCl → KCl + Cl2 ↑+ H2O
(2)浓盐酸在此反应中所具有的性质是 (填写编号)。
①只有还原性 ②还原性和酸性 ③只有氧化性 ④氧化性和酸性
(3)若产生0.3molCl2,则转移电子个数为 。
(4)若反应中HCl的利用率为50%,当反应结束时,生成氯气0.15mol,则浓盐酸的物质的量浓度为 。
(本题共8分)
(1)化学平衡常数K表示可逆反应的进行程度,K值越大,表示_________________,
K值大小与温度的关系是:温度升高,K值______________
(填一定增大、一定减小、或可能增大也可能减小)。
(2)在一体积为10L的容器中,通人一定量的CO和H2O,在850℃时发生如下反应:
CO(g)十H2O(g)  CO2(g)十H2 (g)十Q(Q>0)
CO2(g)十H2 (g)十Q(Q>0)
CO和H2O浓度变化如下图,则 0—4min的平均反应速率v(CO)=______ mol/(L·min)

(3)t℃(高于850℃)时,在相同容器中发生上述反应,容器内各物质的浓度变化如上表。
①表中3min—4min之间反应处于_________状态; C1数值_________0.08 mol/L (填大于、小于或等于)。
②反应在4min—5min问,平衡向逆方向移动,可能的原因是________(单选),表中5min—6min之间数值发生变化,可能的原因是__________(单选)。
a.增加水蒸气 b.降低温度
c.使用催化剂 d.增加氢气浓度
(本题共8分)
NO和CO都是有毒的气体,利用催化技术能够将它们转变成无毒的CO2和N2。一定量的NO和CO进行如下反应:2NO+2CO 2CO2+N2,其部分化学平衡常数如下表:
2CO2+N2,其部分化学平衡常数如下表:
|
T(℃) |
0 |
50 |
100 |
|
K |
0.5 |
1.05 |
2.56 |
根据题意回答(均不考虑温度变化对催化剂催化效率的影响):
1.若把化学方程式写为NO+CO CO2+1/2N2,则100℃时,K的值=
。
CO2+1/2N2,则100℃时,K的值=
。
2.上述反应达到化学平衡后,下列措施能提高NO转化率的是________。
A.选用更有效的催化剂 B.升高反应体系的温度
C.降低反应体系的温度 D.缩小容器的体积
3.若上述反应在容积不变的密闭容器中进行,该可逆反应达到平衡的标志是____
A.气体的密度不再变化
B.单位时间内消耗的CO与生成的CO2的物质的量之比为1︰1
C.气体的压强不再变化
D.各气体的浓度相等
4.某温度下,将0.02 mol的NO和0.02 mol的CO的混合气体充入一装有催化剂的容器中,充分反应后,测得混合气体中CO的体积分数为0.125,则CO的转化率为 。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com