
题目列表(包括答案和解析)
铜是一种与人类关系非常密切的有色金属。常温下,Cu2+在溶液中稳定, Cu+在酸性条件下易发生歧化反应:2Cu+=Cu2++Cu;大多数 +1价铜的化合物是难溶 物,如:Cu20、Cul、CuCl、CuH 等。
(1)在CuCl2溶液中逐滴加入过量KI溶液,可能发生的反应有:
2Cu2++4I-=2CuI↓(白色)+I2; 2Cu2++4I-+2Cl-=CuCl↓(白色)+I2
已知:常温下Ksp(CuCl)=1.20×10-6(mol/L)2; Ksp(CuI)=5.06×10-12(mol/L)2。 由此推断上述反应生成主要沉淀物的化学式是______。
(2)向CuH中加入过量稀HC1,有气体生成,该反应的离子方程式为______。
(3)将 冰 铜(由Cu2S和FeS熔合成含Cu 18%—20%的一种物质)加入熔剂,在髙温下 吹入空气,冰铜中的Cu2S被氧化为Cu2O,生 成 的Cu2O与Cu2S反应生成粗铜。上述两个反应的化学方程式分别是______、______。
(4)常温下,向0.20 mol • L-1硫酸铜溶液中加入氢氧化钠溶液,生成浅蓝色氢氧化铜 沉淀,当溶液的pH = 6时,c(Cu2+)=______mol.L‑1。[已知:Ksp(CuI)=2.2×10-20(mol/L)3]
(5)将0.80 gCuSO4 • 5H2O样品加热分解,其脱水过程中固体质量随温度的变化如下图所示。
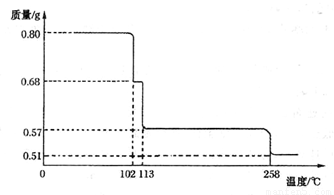
请 确定110°C时固体物质的化学式____________。(要求写出推断过程)
 新修改的《机动车驾驶证申领和使用规定》于2010年4月1日起实施,新规规定酒驾一次扣12分,出此重拳治理酒驾是因为酒后驾车是引发交通事故的重要原因.如图为交警对驾驶员是否饮酒进行检测.其原理如下:
新修改的《机动车驾驶证申领和使用规定》于2010年4月1日起实施,新规规定酒驾一次扣12分,出此重拳治理酒驾是因为酒后驾车是引发交通事故的重要原因.如图为交警对驾驶员是否饮酒进行检测.其原理如下:

(12分)
(1)以甲烷、空气、氢氧化钾溶液为原料,石墨为电极可以构成燃料电池。该电池的负极反应式为 。
(2)用如图所示装置进行电解①若A、B均为石墨电极,C为足量CuS04溶液,则电解的总反应方程式为 。

电解一段时间后,取出电极,向电解液中加入适量的 (填化学式)可使C溶液恢复到电解前的成分和浓度。
②若A、B均为铂电极,C为Na2SO4溶液(含酚酞),电解一段时间后, (填“A”或“B”)极附近显红色;将电极取出,搅拌使溶液混合均匀,测得溶液的pH 7(填“<”、“=”或“>”)。
③若A、B为同一材料的电极,C为CuCl2溶液,电解过程中CuCl2溶液的浓度始终 保持不变,则A、B为 (填化学式)电极;当电路中有0.04 mol电子通过时,阴极增重( ) g。
(12分)化学平衡原理在工农业生产中发挥着重要的指导作用。
(1)反应C(s)+CO2(g)
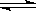 2CO(g)平衡常数K的表达式为
;
2CO(g)平衡常数K的表达式为
;
已知C(s) +
H2O(g)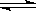 CO(g)+H2(g)的平衡常数为K1;H2(g)+CO2(g)
CO(g)+H2(g)的平衡常数为K1;H2(g)+CO2(g) 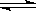 CO(g)+H2O(g)的平衡常数为K2 ,则K与K1、K2二者的关系为
。
CO(g)+H2O(g)的平衡常数为K2 ,则K与K1、K2二者的关系为
。
(2) 已知某温度下,反应2SO2+O2 2SO3,的平衡常数K=19
2SO3,的平衡常数K=19
在该温度下的体积固定的密闭容器中充入C(SO2)=1mol·L-1,C(O2)=1 mol·L-1,当反应在该温度下SO2转化率为80%时,该反应 (填“是”或“否”)达到化学平衡状态,若未达到,向 (填“正反应”或“逆反应”) 方向进行。
(3)对于可逆反应:aA(g) +bB(g) cC(g)+dD(g)
△H = a kJ·mol-1;
cC(g)+dD(g)
△H = a kJ·mol-1;
若a+b>c+d,增大压强平衡向_______(填“正反应”或“逆反应”)方向移动;若升高温度,平衡向逆反应方向移动,则a_______0(填“>”或“<”)
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com