(2012?江苏)废弃物的综合利用既有利于节约资源,又有利于保护环境.实验室利用废旧电池的铜帽(Cu、Zn 总含量约为99%)回收Cu并制备ZnO 的部分实验过程如下:
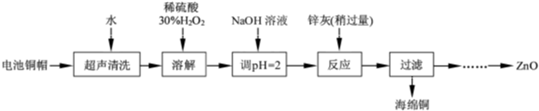
(1)①铜帽溶解时加入H
2O
2 的目的是
Cu+H2O2+H2SO4=CuSO4+2H2O
Cu+H2O2+H2SO4=CuSO4+2H2O
(用化学方程式表示).②铜帽溶解完全后,需将溶液中过量的H
2O
2 除去.除去H
2O
2 的简便方法是
加热至沸
加热至沸
.
(2)为确定加入锌灰(主要成分为Zn、ZnO,杂质为铁及其氧化物)的量,实验中需测定除去H
2O
2 后溶液中Cu
2+的含量.实验操作为:准确量取一定体积的含有Cu
2+的溶液于带塞锥形瓶中,加适量水稀释,调节溶液pH=3~4,加入过量的KI,用Na
2S
2O
3标准溶液滴定至终点.上述过程中反应的离子方程式如下:摇摇2Cu
2++4I
-=2CuI(白色)↓+I
2 2S
2O
32-+I
2=2I
-+S
4O
62-①滴定选用的指示剂为
淀粉溶液
淀粉溶液
,滴定终点观察到的现象为
蓝色褪去
蓝色褪去
.
②若滴定前溶液中的H
2O
2 没有除尽,所测定的Cu
2+含量将会
偏高
偏高
(填“偏高”、“偏低”或“不变”).
(3)已知pH>11 时Zn(OH)
2 能溶于NaOH溶液生成[Zn(OH)
4]
2-.下表列出了几种离子生成氢氧化物沉淀的pH(开始沉淀的pH 按金属离子浓度为1.0mol?L
-1计算).
|
开始沉淀的pH |
沉淀完全的pH |
| Fe3+ |
1.1 |
3.2 |
| Fe2+ |
5.8 |
8.8 |
| Zn2+ |
5.9 |
8.9 |
实验中可选用的试剂:30%H
2O
2、1.0mol?L
-1HNO
3、1.0mol?L
-1NaOH.由除去铜的滤液制备ZnO 的实验步骤依次为:
①
向滤液中加入30%H2O2,使其充分反应
向滤液中加入30%H2O2,使其充分反应
;②
滴加1.0mol?L-1NaOH,调节溶液PH约为5(或3.2≤pH<5.9),使Fe3+沉淀完全
滴加1.0mol?L-1NaOH,调节溶液PH约为5(或3.2≤pH<5.9),使Fe3+沉淀完全
;③过滤;④
向滤液中滴加1.0mol?L-1NaOH,调节溶液PH约为10(或8.9≤pH≤11),使Zn2+沉淀完全
向滤液中滴加1.0mol?L-1NaOH,调节溶液PH约为10(或8.9≤pH≤11),使Zn2+沉淀完全
;⑤过滤、洗涤、干燥;⑥900℃煅烧.