
题目列表(包括答案和解析)
(10分)在某澄清、透明的浅黄色溶液中,可能含有K+、NH4+、Fe3+、Ba2+、Al3+、SO42-、HCO3-、Cl-离子。进行下述实验(所加试剂均过量)。

(1)气体A的化学式是 ,沉淀A的化学式是 ;
(2)待测液中一定存在 ;一定不存在 _______ ;
(3)写出溶液C与过量氨水反应的离子方程式 。
(4)三硅酸镁被用来治疗胃酸过多的胃溃疡,是因为该物质不溶于水,服用后能中和胃酸,作用持久。把三硅酸镁(Mg2Si3O8·nH2O)改写成氧化物的形式为 ,
它中和胃酸(HCl)的离子方程式是: 。
【10分】某学生用胆矾制取氧化铜固体,并研究氧化铜能否在氯酸钾受热分解实验中起催化作用。实验步骤如下:
①称量a g胆矾固体放入烧杯中,加水制成溶液,向其中滴加氢氧化钠溶液至沉淀完全;
②把步骤①中的溶液和沉淀转移至蒸发皿中,加热至溶液中的沉淀全部变成黑色氧化铜为止;
③过滤、洗涤、干燥,称量所得固体质量为b g;
④取一定质量的上述氧化铜固体和一定质量的氯酸钾固体,混合均匀后加热,收集反应生成的氧气,如下图所示。
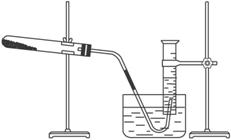
请回答下列问题。
(1)上述各步操作中,需要用到玻璃棒的是_________ (填写前面所述实验步骤的序号)。
(2)由胆矾制备氧化铜的产率(实际产量与理论产量的百分比)为_________×100%。
(3)为保证Cu2+沉淀完全,步骤①中溶液的pH应大于10。简述用pH试纸测定溶液pH的操作:____________________________________________________________________。
(4)为证明氧化铜在氯酸钾的分解反应中起催化作用,在上述实验①—④后还应该进行的实验操作是(按实验先后顺序填写字母序号) _________。
a.过滤 b.烘干 c.溶解 d.洗涤 e.称量
(5)但有的同学认为,还必须另外再设计一个实验才能证明氧化铜在氯酸钾受热分解的实验中起催化作用。你认为还应该进行的另一个实验是_________________________________。
(10分)(1) 某温度(t℃)时,水的Kw=10-13 ,将此温度下pH=11的NaOH溶液aL与pH=1的H2SO4的溶液bL混合,则:
①若所得混合液为中性,则a∶b ;
②若所得混合液的pH=2,则a∶b ;
(2)将等体积的氨水与盐酸溶液混和后,若混和溶液中c(NH4+)=c(Cl-),则溶液中的pH值__ _7,混和前c(NH3·H2O)_ _ c(HCl),氨水中c(OH- ) _盐酸中c(H+)。(填>、<或=,下同)
(10分) 1L某混合溶液,可能含有的离子如下表:
|
可能大量含有的阳离子 |
H+、K+、Mg2+、Al3+、NH、Fe2+、Fe3+ |
|
可能大量含有的阴离子 |
Cl-、Br-、I-、CO32-、AlO |
⑴ 往该溶液中逐滴加入NaOH溶液,产生沉淀的物质的量(n)
与加入NaOH溶液的体积(V)的关系如右图所示。
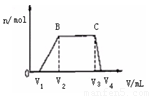
则该溶液中一定不含有的离子是_________。
(2)BC段离子方程式为 。
(3)V1 、V2、 V3、 V4之间的关系 。
(4)经检测,该溶液中还含有大量的Cl-、Br-、I-,若向1L该混合溶液中通入一定量的
Cl2,溶液中Cl-、Br-、I-的物质的量与通入Cl2的体积(标准状况)的关系如下表所示,
分析后回答下列问题:
|
Cl2的体积(标准状况) |
2.8L |
5.6L |
11.2L |
|
n(Cl-) |
1.25mol |
1.5mol |
2mol |
|
n(Br-) |
1.5mol |
1.4mol |
0.9mol |
|
n(I-) |
a mol |
0 |
0 |
①当通入Cl2的体积为2.8L时,溶液中发生反应的离子方程式为___________________。
②原溶液中Cl-、Br-、I-的物质的量浓度之比为____________________。
(10分)在某澄清、透明的浅黄色溶液中,可能含有K+、NH4+、Fe3+、Ba2+、Al3+、SO42-、HCO3-、Cl-离子。进行下述实验(所加试剂均过量)。
(1)气体A的化学式是 ,沉淀A的化学式是 ;
(2)待测液中一定存在 ;一定不存在 _______ ;
(3)写出溶液C与过量氨水反应的离子方程式 。
(4)三硅酸镁被用来治疗胃酸过多的胃溃疡,是因为该物质不溶于水,服用后能中和胃酸,作用持久。把三硅酸镁(Mg2Si3O8·nH2O)改写成氧化物的形式为 ,
它中和胃酸(HCl)的离子方程式是: 。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com