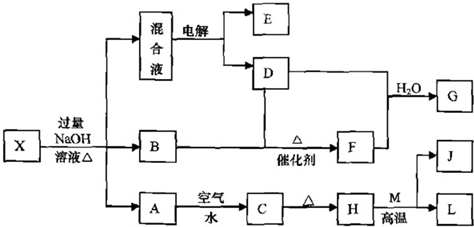
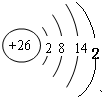
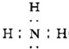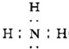(1)某待测液中可能含有A1
3+、Fe
3+、K
+、NH
4+、C1
-等离子,现通过如下实验对其中的阳离子进行检验:
a取少量待测液,仔细观察,呈无色;
b向上述待测液中滴加NaOH溶液,有白色沉淀生成,NaOH溶液过量后沉淀又完全溶解.实验过程中还有刺激性气味的气体产生,该气体能使湿润的红色石蕊试纸变蓝.
据此可以判断该待测液中一定含有的阳离子是
Al3+、NH4+
Al3+、NH4+
,一定没有的阳离子是
Fe3+
Fe3+
.还有一种阳离子没有检验,检验这种离子的实验方法是(填写实验名称)
焰色反应
焰色反应
,现象是
透过蓝色钴玻璃呈紫色
透过蓝色钴玻璃呈紫色
.
(2)溴水和氯化铁溶液是中学化学实验中的常用试剂,浓度较小时,溶液均呈黄色.某同学在探究铁的化合物的相互转化时,进行了如下实验.请你参与讨论.
实验操作:向20mL的FeSO
4溶液中,滴加浓溴水,振荡.
实验现象:溶液由浅绿色(近乎无色)变成黄色.
a溶液颜色发生改变的原因可能是
①②③
①②③
(用选项符号表示).
①使溶液呈黄色的微粒是Br
2 ②使溶液呈黄色的微粒是Fe
3+③使溶液呈黄色的微粒是Fe
3+和Br
2b为进一步探究溴水和FeSO
4溶液是否发生了反应,下列是该同学设计的一些实验方案:
|
操作 |
实验现象及结论 |
| 方案1 |
取少量黄色溶液,加入NaOH |
最终生成红褐色沉淀,说明溴水和FeSO4溶液发生了化学反应 |
| 方案2 |
取少量黄色溶液,加入淀粉碘化钾溶液 |
溶液变蓝色,说明未发生化学反应 |
| 方案3 |
取少量黄色溶液,加入四氯化碳,振荡 |
下层溶液呈橙红色,说明未发生化学反应 |
①方案1的结论是否合理
不合理
不合理
(填“合理”或“不合理”).
②方案2的结论明显不合理,可能发生反应的离子方程式为
Br2+2I-=I2+2Br-
Br2+2I-=I2+2Br-
.
③方案3的结论也不合理,理由是
溴水可能过量
溴水可能过量
.
④你认为判断溴水和FeSO
4溶液是否反应的最简单方法是(填“操作”“现象”“结论”):
取少量溶液,滴加KSCN溶液呈血红色,FeSO4与溴水反应生成Fe3+
取少量溶液,滴加KSCN溶液呈血红色,FeSO4与溴水反应生成Fe3+
.