
题目列表(包括答案和解析)
| I1/KJ·mol-1 | I2/KJ·mol-1 | I3/KJ·mol-1 | I4/KJ·mol-1 | I5/KJ·mol-1 |
| 738 | 1451 | 7733 | 10540 | 13630 |

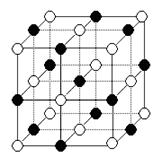
已知NaCI的摩尔质量为58。5g.mol-1,食盐晶体的密度为pg.Cm-3,如图所示为氯化钠晶体的晶胞,若图中N与最邻近的CI-的核间距离为a cm,那么:
 (1)阿伏加德罗常数的值可表示为
(1)阿伏加德罗常数的值可表示为
。
(2)纳米材料的表面原子占总原子数的比例极大,这是它具有许多特殊性质的原因,假设某氯化钠纳米颗粒的大小和形状恰好等于氯化钠晶胞的大小和形状,则这种纳米颗粒的表面原子数与总原子数和比值为 。
随着科学技术的发展,测定阿伏加德罗常数的手段越来越多,测定精确度也越来越高.现有一简单可行的测定方法,具体步骤如下:①将固体食盐研细,干燥后,准确称取m g NaCl固体并转移到定容仪器A中 ②用滴定管向仪器A中加苯,并不断振荡,继续加苯至A仪器的刻度线,计算出NaCl固体的体积为V mL
回答下列问题:
(1)步骤①中A仪器最好用________(填仪器名称)
(2)能否用胶头滴管代替步骤②中的滴定管?其原因是________
(3)能否用水代替苯________________理由是________________
(4)已知NaCl晶胞的结构如图所示,经X射线衍射测得晶胞中最邻近的Na+和C1-平均距离为a cm,则利用上述方法测得的阿伏加德罗常数的表达式为NA=________.

(5)纳米材料的表面原子占总原子数的比例极大,这是它具有许多特殊性质的原因,假设某氯化钠纳米颗粒的大小和形状恰好等于氯化钠晶胞的大小和形状,则这种纳米颗粒的表面原子占总原子数的百分比为________.
| |||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com