
题目列表(包括答案和解析)
(7分,每空1分)如图所示,已知A元素的最低化合价为-3价,它的最高价氧化物含氧56.21%,原子核内中子数比质子数多1,试用相应元素符号或化学式回答: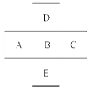
(1)写出它们的元素符号:
A__________,B__________,C___________,D__________。
(2)A、B、C的原子半径由小到大的顺序是________________________________。
(3)A、B、C的最高价氧化物对应水化物的酸性由强到弱的顺序是 ;D、B两元素的气态氢化物稳定性大小顺序是 .
(7分,每空1分)如图所示,已知A元素的最低化合价为-3价,它的最高价氧化物含氧56.21%,原子核内中子数比质子数多1,试用相应元素符号或化学式回答:

(1)写出它们的元素符号:
A__________,B__________,C___________,D__________。
(2)A、B、C的原子半径由小到大的顺序是________________________________。
(3)A、B、C的最高价氧化物对应水化物的酸性由强到弱的顺序是 ;D、B两元素的气态氢化物稳定性大小顺序是 .
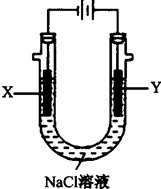
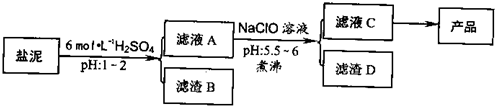
| 沉淀物 | Al(OH)3 | Fe(OH)3 | Fe(OH)2 | Mg(OH)2 |
| pH | 5.2 | 3.2 | 9.7 | 11.2 |
| 温度0C | 10 | 30 | 40 |
| CaSO4 | 0.19 | 0.21 | 0.21 |
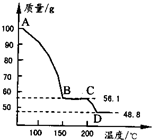
| ||
| ||
 (选做题)
(选做题)| 45V |
| 28 |
| 45V |
| 28 |
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com