
题目列表(包括答案和解析)
| |||||||||||||||||||||||||||||||

| 实验步骤 | 有关问题 |
| ①计算所需NaCl的质量 | |
| ②称量NaCl固体 | 用托盘天平需要称量NaCl的质量为 2.9 2.9 g. |
| ③将NaCl加入100mL烧杯中,并加入适量水 | 为了加快溶解速率,可以采取哪些措施: 用玻璃棒搅拌 用玻璃棒搅拌 . |
| ④将烧杯中溶液转移至250mL容量瓶中 | 为了防止溶液溅出,应采取什么措施: 用玻璃棒引流 用玻璃棒引流 . |
| ⑤向容量瓶中加蒸馏水至刻度线 | 在进行此操作时当加水至刻度线1-2厘米处应如何操作: 改用胶头滴管加水至刻度线 改用胶头滴管加水至刻度线 . |
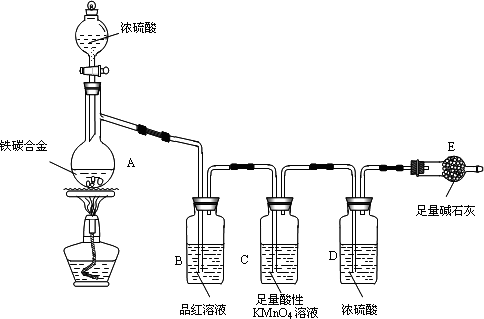
现有某铁碳合金(铁和碳两种单质的混合物),某化学兴趣小组为了测定铁碳合金中铁的质量分数,并探究浓硫酸的某些性质,设计了下图所示的实验装置(夹持仪器已省略)和实验方案进行实验探究。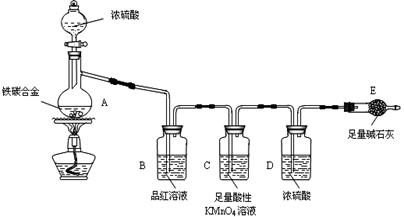
I 测定铁的质量分数:
(1)检查上述装置气密性的一种方法是:关闭分液漏斗的活塞,在E装置后面连上一根导管,然后__________________________________,则证明装置的气密性良好。
(2)称量E的质量,并将a g铁碳合金样品放入装置A中,再加入足量的浓硫酸,待A中不再逸出气体时,停止加热,拆下E并称重,E增重b g。铁碳合金中铁的质量分数为__________________________(写表达式)。
(3)装置C的作用______________________________________________。
(4)甲同学认为,依据此实验测得的数据,计算合金中铁的质量分数可能会偏低,原因是___________________________________________________________。
(5)乙同学按照甲同学认为改进实验,改进方法是______________但测得合金中铁的质量分数却偏高。你认为其中可能的原因是_________________。
Ⅱ 探究浓硫酸的某些性质:
(6)往A中滴加足量的浓硫酸,未点燃酒精灯前,A、B均无明显现象,其原因是:________________________________________________。
(7)A中铁与浓硫酸发生反应的化学方程式是_______________________。
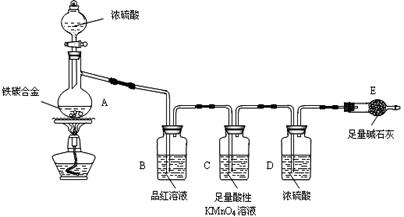
现有某铁碳合金(铁和碳两种单质的混合物),某化学兴趣小组为了测定铁碳合金中铁的质量分数,并探究浓硫酸的某些性质,设计了下图所示的实验装置(夹持仪器已省略)和实验方案进行实验探究.
Ⅰ测定铁的质量分数:
(1)检查上述装置气密性的一种方法是:关闭分液漏斗的活塞,在E装置后面连上一根导管,然后________,则证明装置的气密性良好.
(2)称量E的质量,并将a g铁碳合金样品放入装置A中,再加入足量的浓硫酸,待A中不再逸出气体时,停止加热,拆下E并称重,E增重b g.铁碳合金中铁的质量分数为________(写表达式).
(3)装置C的作用________.
(4)甲同学认为,依据此实验测得的数据,计算合金中铁的质量分数可能会偏低,原因是空气中CO2、H2O进入E管使b增大.你认为改进的方法是________.
(5)乙同学认为,即使甲同学认为的偏差得到改进,依据此实验测得合金中铁的质量分数也可能会偏高.你认为其中的原因是________.
Ⅱ探究浓硫酸的某些性质:
(6)往A中滴加足量的浓硫酸,未点燃酒精灯前,A、B均无明显现象,其原因是:________.
(7)A中铁与浓硫酸发生反应的化学方程式是________.
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com