
题目列表(包括答案和解析)
卤素单质的性质活泼,卤素的化合物应用广泛,运用化学反应原理研究卤族元素的有关性质具有重要意义。
(1)下列关于氯水的叙述正确的是_______(填写序号)。
A.氯水中存在两种电离平衡????????????????????
B.向氯水中通入SO2,其漂白性增强
C.向氯水中通入氯气,c( H+)/c(ClO-)减小???????
D.加水稀释氯水,溶液中的所有离子浓度均减小
E.加水稀释氯水,水的电离平衡向正反应方向移动
F.向氯水中加少量固体NaOH,可能有c(Na+)=c(Cl- )+c(ClO-)
(2)工业上通过氯碱工业生产氯气,其反应的离子方程式为______。
(3)常温下,已知25℃时有关弱酸的电离平衡常数:

写出84消毒液(主要成分为NaClO)露置在空气中发生反应的有关化学方程式________。若将84消毒液与洁厕剂(含有浓盐酸)混合使用可能会导致中毒,请用离子方程式解释有关原因___________。
(4)碘钨灯具有比白炽灯寿命长且环保节能的;特点。一定温度下,灯泡内封存的少量碘与使用过程中沉积在管壁上的钨可以发生反应:  。为模拟上述反应,准确称取0. 508g碘、0.736g金属钨置于50. 0mL的密闭容器中,加热使其反应。如图是 WI2(g)的物质的量随时间变化关系图象,其中曲线I(0~t2时间段)的反应温度为T1,曲线II(从t2开始)的反应温度为T2,且T2>T1。则
。为模拟上述反应,准确称取0. 508g碘、0.736g金属钨置于50. 0mL的密闭容器中,加热使其反应。如图是 WI2(g)的物质的量随时间变化关系图象,其中曲线I(0~t2时间段)的反应温度为T1,曲线II(从t2开始)的反应温度为T2,且T2>T1。则

①该反应的△H_______0(填“>。、=或“<”)
②从反应开始到t1时间内的平均反应速率v(I2)=_________。
③下列说法中不正确的是_________(填序号),
A.利用该反应原理可以提纯钨
B.该反应的平衡常数表达式是K=
C.灯丝附近温度越高,灯丝附近区域WI2越易变为W而重新沉积到灯丝上
(5)25℃时,向5mL含有KCI和KI浓度均为0.1mol/L的混合液中,滴加6mL0.1mol/L的AgNO3溶液,先生成的沉淀是_________,溶液中离子浓度由大到小的顺序是_______ [不考虑H+和OH-。25℃时
 ]。
]。
卤素单质的性质活泼,卤素的化合物应用广泛,运用化学反应原理研究卤族元素的有关性质具有重要意义。
(1)下列关于氯水的叙述正确的是_______(填写序号)。
A.氯水中存在两种电离平衡
B.向氯水中通入SO2,其漂白性增强
C.向氯水中通入氯气,c( H+)/c(ClO-)减小
D.加水稀释氯水,溶液中的所有离子浓度均减小
E.加水稀释氯水,水的电离平衡向正反应方向移动
F.向氯水中加少量固体NaOH,可能有c(Na+)=c(Cl- )+c(ClO-)
(2)工业上通过氯碱工业生产氯气,其反应的离子方程式为______。
(3)常温下,已知25℃时有关弱酸的电离平衡常数:
写出84消毒液(主要成分为NaClO)露置在空气中发生反应的有关化学方程式________。若将84消毒液与洁厕剂(含有浓盐酸)混合使用可能会导致中毒,请用离子方程式解释有关原因___________。
(4)碘钨灯具有比白炽灯寿命长且环保节能的;特点。一定温度下,灯泡内封存的少量碘与使用过程中沉积在管壁上的钨可以发生反应:  。为模拟上述反应,准确称取0. 508g碘、0.736g金属钨置于50. 0mL的密闭容器中,加热使其反应。如图是 WI2(g)的物质的量随时间变化关系图象,其中曲线I(0~t2时间段)的反应温度为T1,曲线II(从t2开始)的反应温度为T2,且T2>T1。则
。为模拟上述反应,准确称取0. 508g碘、0.736g金属钨置于50. 0mL的密闭容器中,加热使其反应。如图是 WI2(g)的物质的量随时间变化关系图象,其中曲线I(0~t2时间段)的反应温度为T1,曲线II(从t2开始)的反应温度为T2,且T2>T1。则
①该反应的△H_______0(填“>。、=或“<”)
②从反应开始到t1时间内的平均反应速率v(I2)=_________。
③下列说法中不正确的是_________(填序号),
A.利用该反应原理可以提纯钨
B.该反应的平衡常数表达式是K=
C.灯丝附近温度越高,灯丝附近区域WI2越易变为W而重新沉积到灯丝上
(5)25℃时,向5mL含有KCI和KI浓度均为0.1mol/L的混合液中,滴加6mL0.1mol/L的AgNO3溶液,先生成的沉淀是_________,溶液中离子浓度由大到小的顺序是_______ [不考虑H+和OH-。25℃时
 ]。
]。

 。为模拟上述反应,准确称取0. 508g碘、0.736g金属钨置于50. 0mL的密闭容器中,加热使其反应。如图是 WI2(g)的物质的量随时间变化关系图象,其中曲线I(0~t2时间段)的反应温度为T1,曲线II(从t2开始)的反应温度为T2,且T2>T1。则
。为模拟上述反应,准确称取0. 508g碘、0.736g金属钨置于50. 0mL的密闭容器中,加热使其反应。如图是 WI2(g)的物质的量随时间变化关系图象,其中曲线I(0~t2时间段)的反应温度为T1,曲线II(从t2开始)的反应温度为T2,且T2>T1。则


 ]。
]。化学学习中,有关物质性质的学习离不开实验,请阅读下列对应的内容,并按要求完成填空
(1)实验室经常用烧杯进行性质实验研究,如图所示装置及下表中试剂,过一段时间

|
实验编号 |
①中的物质 |
②中的物质 |
|
1 |
淀粉碘化钾溶液 |
浓硝酸 |
|
2 |
酚酞溶液 |
浓硫酸 |
|
3 |
氯化铝溶液 |
浓氨水 |
|
4 |
湿润的红纸 |
饱和氯水 |
实验1、2、3、4烧杯①中的现象分别是 , , , ,
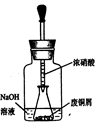
(2)用下图装置:废铜屑制硝酸铜,反应结束后,广口瓶内的溶液中,除了含有NaOH外,还有____(填写化学式)

(3)浓氨水通常可以用于实验室快速制取氨气及其相关实验的探究,回答下列问题.

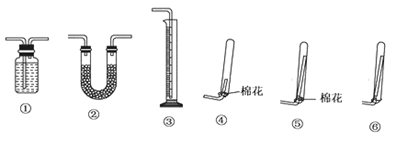
①若要测定生成的NH3的体积,则必须选择的装置是 (填装置序号),装置中所盛试剂应具有的性质是 .收集干燥的NH3,收集装置应选择(填装置序号) ,理由是 .
②向浓CaCl2溶液中先通入NH3再通入CO2气体可制纳米级(粒子直径在1—10nm之间)碳酸钙,试写出制纳米级碳酸钙的离子方程式 。
(4)下图是苯与溴发生反应并进行产物检验的反应装置
实验装置中的冷凝管“左低右高”的放置目的是____________,整套实验装置中能防止倒吸的装置是______________(填装置序号)
对于固体硫化钠露置在空气中的变化,有如下假设:
假设①:固体硫化钠易被空气中的氧气氧化为单质硫。
假设②:固体硫化钠易被空气中的氧气氧化为亚硫酸钠。
假设③:固体硫化钠易被空气中的氧气氧化为硫酸钠。
为了探究固体硫化钠露置在空气中究竟有怎样的变化,某化学学习小组进行了如下实验:
①从试剂瓶中取出固体硫化钠样品,放在研钵中研碎。
②将研钵中的样品露置在空气中两天。
③从研钵中取出一药匙样品放在试管中,加入盐酸,试样全部溶解,得到澄清溶液,并放出大量气泡。
④立即加塞,用力振荡,产生浑浊,且气泡的量大大减少。
(5)解释加塞振荡后产生浑浊,且气泡大量减少的原因(用化学方程式表示)_____________。
(6)如果要验证③是否成立的实验方法是______________________
化学学习中,有关物质性质的学习离不开实验,请阅读下列对应的内容,并按要求完成填空
(1)实验室经常用烧杯进行性质实验研究,如图所示装置及下表中试剂,过一段时间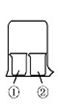
| 实验编号 | ①中的物质 | ②中的物质 |
| 1 | 淀粉碘化钾溶液 | 浓硝酸 |
| 2 | 酚酞溶液 | 浓硫酸 |
| 3 | 氯化铝溶液 | 浓氨水 |
| 4 | 湿润的红纸 | 饱和氯水 |
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com