
题目列表(包括答案和解析)
| |||||||||||||||||||
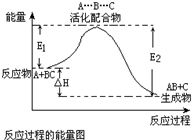
| A、反应过程可表示为A+BC-→[A…B…C]-→AB+C (反应物)(过渡态) (产物) | B、E1为反应物的平均能量与过渡态的能量差,称为正反应的活化能 | C、正反应的热效应为△H=E1-E2,且E2>E1,所以正反应为放热反应 | D、此图中逆反应的热效应△H=E1-E2,为吸热反应 |
 某反应过程中体系的能量变化如图所示,下列说法错误的是( )
某反应过程中体系的能量变化如图所示,下列说法错误的是( )某反应过程中体系的能量变化如图所示,下列说法错误的是 ( )
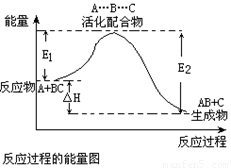
A.反应过程可表示为:
A+BC-→[A…B…C] -→AB+C
(反应物)(过渡态) (产物)
B.E1为反应物的平均能量与过渡态的能量差,称为正反应的活化能
C.正反应的热效应为△H=E1-E2,且E2>E1,所以正反应为放热反应
D.此图中逆反应的热效应△H=E1-E2,为吸热反应
化学能的转化在现实生活中得到了广泛的利用。回答以下问题:
(Ⅰ)(1) 在25℃、101kPa下, 1g甲烷完全燃烧生成CO2和液态H2O,放出55 kJ的热量,写出表示甲烷燃烧的热化学方程式:
。
(2)2Zn(s)+O2(g)=2ZnO(s) ΔH1 = —702 kJ/mol
2Hg(l)+O2(g)=2HgO(s) ΔH2 = —182 kJ/mol
由此可知ZnO(s)+Hg(l)= Zn(s)+HgO(s) △H3= 。
(3)20世纪30年代,Eyring和Pelzer在碰撞理论的基础上提出化学反应的过渡态理论:化学反应并不是通过简单的碰撞就能完成的,而是在反应物到生成物的过程中经过一个高能量过渡态。下图是NO2和CO反应生成CO2和NO过程中能量变化示意图,请写出NO2和CO反应的热化学方程式:

(Ⅱ)下图为相互串联的甲乙两个电解池:

请回答:
(1)甲池若为用电解原理精炼铜的装置,则:
A极是 极,材料是 ,电极反应为 ,
B极是 极,材料是 ,电极反应为 ,
电解质溶液为 。
(2)乙池中若滴入少量酚酞试液,开始一段时间后,Fe极附近呈 色。
(3)若甲槽阴极增重12.8g,则乙槽阳极放出气体在标准状况下的体积
________________________________。
(4)同时若乙槽剩余液体为400mL,则电解后得到碱液的物质的量浓度为
__ _____。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com