
题目列表(包括答案和解析)
“低碳循环”引起各国的高度重视,而如何降低大气中CO2的含量及有效地开发利用CO2,引起了全世界的普遍重视。所以“低碳经济”正成为科学家研究的主要课题。
(1)用电弧法合成的储氢纳米碳管常伴有大量的碳纳米颗粒(杂质),这种颗粒可用如下氧化法提纯,请完成该反应的化学方程式:(将配平后的系数填在横线上)
__ C+ __ KMnO4+ ___ H2SO4→___CO2↑+ ___MnSO4 + ___K2SO4+ ___H2O
(2)将不同量的CO(g)和H2O(g)分别通入到体积为2L的恒容密闭容器中,进行反应CO(g)+H2O(g) ![]() CO2(g)+H2(g),得到如下三组数据:
CO2(g)+H2(g),得到如下三组数据:
| 实验组 | 温度℃ | 起始量/mol | 平衡量/mol | 达到平衡所需时间/min | ||
| CO | H2O | H2 | CO | |||
| 1 | 650 | 4 | 2 | 1.6 | 2.4 | 6 |
| 2 | 900 | 2 | 1 | 0.4 | 1.6 | 3 |
| 3 | 900 | a | b | c | d | t |
①实验1中以v (CO2)表示的反应速率为 (取小数二位,下同)。
②该反应为 (填“吸”或“放”)热反应,实验2条件下平衡常数K= 。
(3)已知在常温常压下:
① 2CH3OH(l) + 3O2(g) = 2CO2(g) + 4H2O(g) ΔH =-1275.6 kJ/mol
② 2CO (g)+ O2(g) = 2CO2(g) ΔH =-566.0 kJ/mol
③ H2O(g) = H2O(l) ΔH =-44.0 kJ/mol
写出甲醇不完全燃烧生成一氧化碳和液态水的热化学方程式
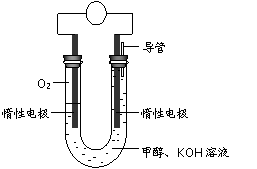 |
⑷某实验小组依据甲醇燃烧的反应原理,设计如右图所示的电池装置。
①该电池正极的电极反应为 。
②工作一段时间后,测得溶液的pH减小,该电池总反应的化学方程式为 。
(5)CO2在自然界循环时可与CaCO3反应,CaCO3是一种难溶物质,其Ksp=2.8×10—9。CaCl2溶液与Na2CO3溶液混合可形成CaCO3沉淀,现将等体积的CaCl2溶液与Na2CO3溶液混合,若Na2CO3溶液的浓度为2×10—4mo1/L ,则生成沉淀所需CaCl2溶液的最小浓度为 。
(2011?大兴区二模)常温下,将不同浓度的氨水与盐酸等体积混合,两种溶液的浓度和混合后所得溶液的pH如下表,则下列说法不正确的是
|
| ||
(12分)蛇纹石可用于生产氢氧化镁,简要工艺流程如下:
I.制取粗硫酸镁:用酸液浸泡蛇纹石矿粉,过滤;并在常温常压下结晶,制得粗硫酸镁
(其中常含有少量Fe3+、Al3+、Fe2+等杂质离子)。
II.提纯粗硫酸镁:将粗硫酸镁在酸性条件下溶解,加入适量的0.1 mol/L H2O2溶液,再
调节溶液pH至7~8,并分离提纯。
III.制取氢氧化镁:向步骤II所得溶液中加入过量氨水。
已知:金属离子氢氧化物沉淀所需pH
| | Fe3+ | Al3+ | Fe2+ | Mg2+ |
| 开始沉淀时 | 1.5 | 3.3 | 6.5 | 9.4 |
| 沉淀完全时 | 3.7 | 5.2 | 9.7 | 12.4 |
| | 平行测定数据 | 平均值 | |||
| 实验编号 | 1 | 2 | 3 | 4 | |
| 消耗H2O2溶液的体积/mL | 0.32 | 0.30 | 0.30 | 0.32 | 0.31 |
 Mg2+ (aq)+ 2OH- (aq) Ksp = c(Mg2+)·c2( OH-) = 5.6×10-12
Mg2+ (aq)+ 2OH- (aq) Ksp = c(Mg2+)·c2( OH-) = 5.6×10-12 Ca2+ (aq) + 2OH- (aq) Ksp = c(Ca2+)·c2(OH-) = 4.7×10-6
Ca2+ (aq) + 2OH- (aq) Ksp = c(Ca2+)·c2(OH-) = 4.7×10-6过氧化镁(MgO2)易溶于稀酸,溶于酸后产生过氧化氢,在医学上可作为解酸剂等。过氧化镁产品中常会混有少量MgO,实验室可通过多种方案测定样品中过氧化镁的含量。
(1)某研究小组拟用右图装置测定一定质量的样品中过氧化镁的含量。
①实验前需进行的操作是 ,稀盐酸中加入少量FeCl3溶液的作用是 。
②用恒压分液漏斗的优点有:使分液漏斗中的溶液顺利滴下; 。
③实验终了时,待恢复至室温,先 ,再平视刻度线读数。
(2)实验室还可通过下列两种方案测定样品中过氧化镁的含量:
方案I:取a g样品,加入足量稀盐酸,充分反应后再加入 NaOH溶液至Mg2+沉淀完全,过滤、洗涤后,将滤渣充分灼烧,最终得到b g固体。
已知常温下Ksp[Mg(OH)2]=l×10-11。为使方案I中Mg2+完全沉淀[即溶液中c(Mg2+)≤l ×10-5mol/L],溶液的pH至少应调至 。
方案Ⅱ:用电子天平称取0.1000g样品置于锥形瓶中,加入15 mL0.6 mol/LKI溶液和足量盐酸,摇匀后在暗处静置5 min,加入少量 作指示剂;然后用 式滴定管盛装0. 1000 mol/L Na2S2O3溶液进行滴定. (已知:I2+2Na2S2O3= Na2S4O6+2NaI)

湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com