
题目列表(包括答案和解析)
为了测定氢氧化钠固体混合物m g中碳酸钠的质量分数,某探究活动小组分别设计了如下实验方案:
(1)甲同学用如图一所示装置,通过测定放出CO2的体积来确定碳酸钠的质量分数,结果误差较大,请你提出改进措施 ;
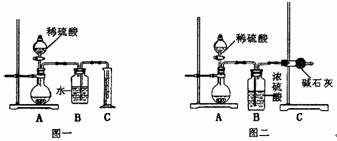
(2)乙同学用图二所示装置,通过测定反应放出CO2的质量来确定碳酸钠的质量分数,他重复正确操作三次,结果数据出现了较大偏差。你认为主要原因可能是(任写两个)
①
②
(3)丙同学认为上面的测定方法误差都较大,提出用中和滴定来测定。方法是:准确称取氢氧化钠样品m g,放入锥形瓶中加蒸馏水溶解,加1―2滴酚酞指示剂,用物质的量浓度为c mol?L―1的HCl溶液滴定至溶液由红色至无色(指示CO32―+H+=HCO3―反应的终点),消耗HCl溶液体积为V1mL,再加入1―2滴甲基橙指示剂,继续用HCl溶液滴定至溶液由黄变橙(指示H++HCO3―=CO2↑+H2O反应的终点),又消耗HCl溶液体积为V2ml。则烧碱样品中Na2CO3的质量分数为 ;
(4)请你设计另外一个简单的实验方案来测定NaOH固体混合物中Na2CO3的质量分数。
①写出操作步骤
②用测得的数据(用字母表示)写出质量分数的表达式 。
⑴(8分)甲、乙两个实验小组分别进行“测定Na2CO3和NaCl混合物中Na2CO3含量”的实验。
甲组:沉淀分析法
把一定量的混合物溶解后加入过量CaCl2,然后将所得沉淀过滤、洗涤、烘干、称量,所得固体是 (填化学式);写出该反应的离子方程式________________________ __。
 乙组:气体分析法
乙组:气体分析法
把一定量的混合物与足量盐酸反应后,用如图装置测定产生的CO2气体的体积,为减小CO2的溶解,B中溶液应是_________________,(将选项填入空格中)
A.氢氧化钠溶液 B.饱和氯化钠溶液 C.饱和碳酸氢钠溶液
选用该溶液后实验结果还是不准确,原因是_________________________________。
⑵(5分)某实验小组对中学课本中可生成氢气的反应进行了研究,总结出三个可以生成H2的反应:
① Zn+盐酸;② Na+水;③ Al+NaOH溶液。为点燃上述三个反应生成的H2,他们设计了如下图(原实验)所示的装置图,请回答下列问题:
①写出Al和NaOH溶液反应的化学方程式 。
② 实验小组在点燃用此装置制得的H2时,①③实验获得成功,②却失败了。他们分析认为失败的原因是Na与H2O的反应速率太快,Na的用量又太少。于是他们准备增加钠的用量,可老师说太危险,你认为产生危险的原因是 。
③ 实验小组查阅钠、苯(一种不溶于水的液态有机物)、水的密度分别为0.97g/mL、0.88g/mL、1.00g/mL,并据此对实验进行了改进。

在改进后的实验中H2的生成速率减慢。原因是 。
下列实验操作或对实验事实的叙述正确的是________(填序号)
①为了提高纯锌与稀硫酸反应的速率,可向稀硫酸中滴入几滴CuSO4溶液;
②向沸腾的NaOH稀溶液中滴加FeCl3饱和溶液,以制备Fe(OH)3胶体;
③使用胶头滴管的任何实验都不允许将滴管插入液面以下;
④为了获得胆矾晶体,可将CuSO4溶液蒸干、灼烧到质量不再发生变化时为止;
⑤不慎将苯酚溶液沾到皮肤上,立即用酒精清洗;
⑥用石英坩埚高温熔融NaOH和Na2CO3的固体混合物;
⑦配制浓硫酸和浓硝酸的混合酸时,将浓硫酸沿器壁慢慢加入到浓硝酸中,并不断搅拌;
⑧用洁净的玻璃棒蘸取浓HNO3,点在pH试纸中部以测定此浓HNO3的pH.
下列实验操作或对实验事实的叙述正确的是__________(填序号)
① 为了提高纯锌与稀硫酸反应的速率,可向稀硫酸中滴入几滴CuSO4溶液;
② 向沸腾的NaOH稀溶液中滴加FeCl3饱和溶液,以制备Fe(OH)3胶体;
③ 使用胶头滴管的任何实验都不允许将滴管插入液面以下;
④ 为了获得胆矾晶体,可将CuSO4溶液蒸干、灼烧到质量不再发生变化时为止;
⑤ 不慎将苯酚溶液沾到皮肤上,立即用酒精清洗;
⑥ 用石英坩埚高温熔融NaOH和Na2CO3的固体混合物;
⑦ 配制浓硫酸和浓硝酸的混合酸时,将浓硫酸沿器壁慢慢加入到浓硝酸中,并不断搅拌;
⑧ 用洁净的玻璃棒蘸取稀硫酸,点在pH试纸中部以测定此稀硫酸的pH。
| 实验 序号 |
混合物 |
第一步: 加入适量水,充分溶解 |
第二步: 加入或通入的试剂 |
第三步: 过滤后洗涤干燥所得固体 |
第四步: 蒸发滤液得到晶体 |
第五步: 称量,记录数据 |
| 甲 | BaCl2 NaCl |
澄清溶液 | 过量CO2 | 无固体 | 晶体 | 称量所得晶体 |
| 乙 | CaCl2 NaCl |
澄清溶液 | 过量饱和Na2CO3溶液 | CaCO3 | NaCl | 称量蒸发所得晶体 |
| 丙 | Na2SO4 MgSO4 |
澄清溶液 | 过量NaOH溶液 |
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com