
题目列表(包括答案和解析)
(9分)现有反应:mA(g)+nB(g)pC(g),达到平衡后,当升高温度时,B的转化率变大;当减小压强时,混合体系中C的质量分数也减小,则:
(1)该反应的逆反应为_________热反应,且m+n_________p(填“>”“=”“<”)。
(2)减压时,A的质量分数_________。(填“增大”“减小”或“不变”,下同)
(3)若加入B(体积不变),则A的转化率_________,B的转化率_________。
(4)若升高温度,则平衡时B、C的浓度之比![]() 将______ ___。
将______ ___。
(5)若加入催化剂,平衡时气体混合物的总物质的量____ _____。
(6)若B是有色物质,A、C均无色,则加入C(体积不变)时混合物颜色______ _;而维持容器内压强不变,充入氖气时,混合物颜色____ ___(填“变深”“变浅”或“不变”)。
(9分)现有反应:mA(g)+nB(g) pC(g),达到平衡后,当升高温度时,B的转化率变大;当减小压强时,混合体系中C的质量分数也减小,则:
pC(g),达到平衡后,当升高温度时,B的转化率变大;当减小压强时,混合体系中C的质量分数也减小,则:
(1)该反应的逆反应为_________热反应,且m+n_________p(填“>”“=”“<”)。
(2)减压时,A的质量分数_________。(填“增大”“减小”或“不变”,下同)
(3)若加入B(体积不变),则A的转化率_________,B的转化率_________。
(4)若升高温度,则平衡时B、C的浓度之比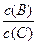 将_________。
将_________。
(5)若加入催化剂,平衡时气体混合物的总物质的量____ _____。
(6)若B是有色物质,A、C均无色,则加入C(体积不变)时混合物颜色______ _;而维持容器内压强不变,充入氖气时,混合物颜色____ ___(填“变深”“变浅”或“不变”)。
(9分)现有反应:mA(g)+nB(g) pC(g),达到平衡后,当升高温度时,B的转化率变大;当减小压强时,混合体系中C的质量分数也减小,则:
pC(g),达到平衡后,当升高温度时,B的转化率变大;当减小压强时,混合体系中C的质量分数也减小,则:
(1)该反应的逆反应为_________热反应,且m+n_________p(填“>”“=”“<”)。
(2)减压时,A的质量分数_________。(填“增大”“减小”或“不变”,下同)
(3)若加入B(体积不变),则A的转化率_________,B的转化率_________。
(4)若升高温度,则平衡时B、C的浓度之比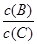 将______ ___。
将______ ___。
(5)若加入催化剂,平衡时气体混合物的总物质的量____ _____。
(6)若B是有色物质,A、C均无色,则加入C(体积不变)时混合物颜色______ _;而维持容器内压强不变,充入氖气时,混合物颜色____ ___(填“变深”“变浅”或“不变”)。
 pC(g),达到平衡后,当升高温度时,B的转化率变大;当减小压强时,混合体系中C的质量分数也减小,则:
pC(g),达到平衡后,当升高温度时,B的转化率变大;当减小压强时,混合体系中C的质量分数也减小,则: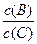 将_________。
将_________。利用催化氧化反应将SO2转化为SO3是工业上生产硫酸的关键步骤。
(1)某温度下,2SO2(g)+ O2(g) 2SO3(g);△H= mkJ·mol-1
K的大小与温度(T)的关系如右图中曲线所示,则m 0(填“>”“=”或“<”);
b点时v(正) v(逆)(填“<”、“>”或“=”)。反应的焓变(△H)将 (填“增大”、“减小”或“不变”)。
(2)若反应物起始的物质的量相同,下列关系图错误的是________ (填序号)。
(3)某硫酸厂利用S02尾气、废铁屑、空气、水合成绿矾(FeS04·7H20),反应中作还原剂的物质是 。
(4)将反应后的混合气体用氨水吸收可得到(NH4)2SO3和(NH4)2SO4两种化工原料
①对于(NH4)2SO3溶液,某同学写出了如下的正确关系式:
2[c(SO32-)+c(HSO3-)+c(H2SO3)]=c(NH4+)+c(NH3·H2O)
请分析该同学的依据是
②在(NH4)2SO4溶液中存在:NH4++H2ONH3·H2O+H+,则该反应常温下的平衡常数K= (已知:常温下,
![]() 的电离平衡常数Kb=1.7×10—5mol·L—1)
的电离平衡常数Kb=1.7×10—5mol·L—1)
(5)三氧化硫吸收后所得的硫酸常用来制备BaSO4作X射线透视时的内服造影剂,胃酸很强(pH约为1),但服用大量BaSO4仍然是安全的,BaSO4不溶于酸的原因是(用溶解平衡原理解释) 。万一误服了少量BaCO3,应尽快用大量0.5mol/LNa2SO4溶液给患者洗胃,如果忽略洗胃过程中Na2SO4溶液浓度的变化,残留在胃液中的Ba2+浓度仅为 mol/L(己知25℃时,Ksp(BaSO4)=l×10-10,Ksp(BaCO3)=1×l0-9)。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com