
题目列表(包括答案和解析)
(16分) (1)将2mol SO2和1mol O2放入2L密闭容器中发生如下反应:
2SO2+O2 2SO3△H<0
2SO3△H<0
当达到平衡时,由于条件改变而引起反应速度和化学平衡的变化情况,如下图表示:
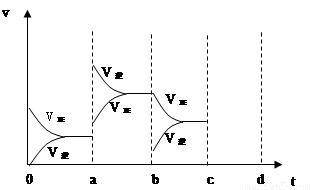
(1)a b过程中改变的条件可能是 ;
(2)b c过程中改变的条件可能是 ;
(3)若增大压强时,反应速度变化情况画在c~d处;
(4) 达到第一个平衡时,测得平衡时SO3的浓度为0.5mol/L。请计算此条件下的平衡常数和SO2的转化率。(要求写出解题过程)
(16分) (1)将2mol SO2和1mol O2放入2L密闭容器中发生如下反应:
2SO2+O2 2SO3△H<0
2SO3△H<0
当达到平衡时,由于条件改变而引起反应速度和化学平衡的变化情况,如下图表示: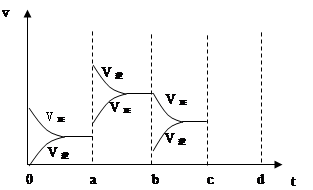
(1)a b过程中改变的条件可能是 ;
(2)b c过程中改变的条件可能是 ;
(3)若增大压强时,反应速度变化情况画在c~d处;
(4) 达到第一个平衡时,测得平衡时SO3的浓度为0.5mol/L。请计算此条件下的平衡常数和SO2的转化率。(要求写出解题过程)
根据图所示的化学反应框图解题。
(1)单质F是__________,溶液H中所含的主要离子是_________________________。
(2)写出下列反应的化学方程式:
C+L―→F+E:_ _ ____,
B―→F+H:_____ ___ ______。
(3)写出下列反应的离子方程式:
E+Cl2―→G:____ ____________ _______,
G+C―→E:____ ___ ________,
D―→H:__________________________________ ________。
(4)由C―→E+F若改用浓酸,则不能选用的浓酸是_____ ___(填化学式)。

2 g Cu2S和CuS的混合物在酸性溶液中用400 mL 0.075 mol/L KMnO4溶液处理,发生反应如下:
8MnO4-+5Cu2S+44H+=10Cu2++5SO2+8Mn2++22H2O
6MnO4-+5CuS+28H+=5Cu2++5SO2+6Mn2++14H2O
反应后煮沸溶液,赶尽SO2,剩余的KMnO4恰好与350 mL 0.1 mol/L(NH4)2Fe(SO4)2溶液完全反应.
(1)配平KMnO4与(NH4)2Fe(SO4)2反应的离子方程式:
(2)KMnO4溶液与混合物反应,消耗KMnO4的物质的量为________mol.
(3)欲配制500 mL 0.1 mol/L NH4+溶液,需称取(NH4)2Fe(SO4)2·6H2O(M=392 g/mol)的质量为________g.
(4)混合物中Cu2S的质量分数为________.(该小题请写出解题过程)
有一种矿物,它的化学式可表示为MgxBay(CO3)z,现用下述方法对它进行分析,根据所得结果,求该矿物的化学式.(请写出解题过程)
用过量盐酸溶解一份矿样,所得溶液用水稀释至100mL,在这过程中放出44.8mL CO2(标况).取25.0mL所得溶液,需要用25.0mL浓度为0.02mol·L-1的EDTA溶液(一种配合剂)滴定才能到达终点,用过量的稀H2SO4去处理另一份25.0mL的溶液,结果得到0.058g BaSO4沉淀,计算时可以假设第ⅡA族金属离子跟EDTA反应生成1∶1的生成物(配合物).
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com