
题目列表(包括答案和解析)
下列说法正确的是
A.分散系中分散质粒子的大小:Fe(OH)3悬浊液<Fe(OH)3胶体<FeCl3溶液
B.可利用反应2CO=2C+O2( H>O、
H>O、 S<0)来消除CO污染
S<0)来消除CO污染
C.若弱酸HA的酸性强于弱酸HB,则相同物质的量浓度的钠盐溶液的碱性:NaA<NaB
D.除去Cu粉中混有的CuO,可将混合物加入稀硝酸中,充分反应后过滤、洗涤
| A.分散系中分散质粒子的大小:Fe(OH)3悬浊液<Fe(OH)3胶体<FeCl3溶液 |
B.可利用反应2CO=2C+O2(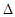 H>O、 H>O、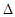 S<0)来消除CO污染 S<0)来消除CO污染 |
| C.若弱酸HA的酸性强于弱酸HB,则相同物质的量浓度的钠盐溶液的碱性:NaA<NaB |
| D.除去Cu粉中混有的CuO,可将混合物加入稀硝酸中,充分反应后过滤、洗涤 |
下列说法正确的是
| A.分散系中分散质粒子的大小:Fe(OH)3悬浊液<Fe(OH)3胶体<FeCl3溶液 |
B.可利用反应2CO=2C+O2(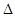 H>O、 H>O、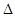 S<0)来消除CO污染 S<0)来消除CO污染 |
| C.若弱酸HA的酸性强于弱酸HB,则相同物质的量浓度的钠盐溶液的碱性:NaA<NaB |
| D.除去Cu粉中混有的CuO,可将混合物加入稀硝酸中,充分反应后过滤、洗涤 |
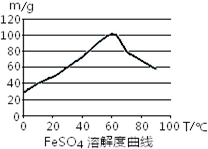 铁盐、亚铁盐在工农业生产、生活、污水处理等方面有着极其广泛的应用.
铁盐、亚铁盐在工农业生产、生活、污水处理等方面有着极其广泛的应用.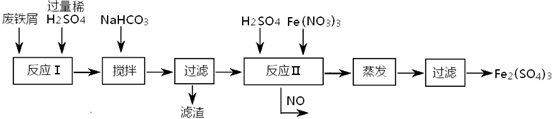
| 沉淀物 | Fe(OH)3 | Fe(OH)2 | Al(OH)3 | Cu(OH)2 |
| 开始沉淀 | 2.3 | 7.5 | 3.4 | 4.7 |
| 完全沉淀 | 3.2 | 9.7 | 4.4 | 6.7 |
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com