
题目列表(包括答案和解析)
[化学一选修2:化学与技术](15分)已知:
①工业上用硫酸与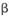 -锂辉矿(LiAlSi2O6和少量钙镁杂质)反应,生成Li2SO4、MgSO4等,最终制备金属锂。
-锂辉矿(LiAlSi2O6和少量钙镁杂质)反应,生成Li2SO4、MgSO4等,最终制备金属锂。
②氢氧化锂在一定温度下可转化为氧化锂。用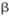 -锂辉矿与硫酸等物质制备金属锂的工业流程如下图:
-锂辉矿与硫酸等物质制备金属锂的工业流程如下图: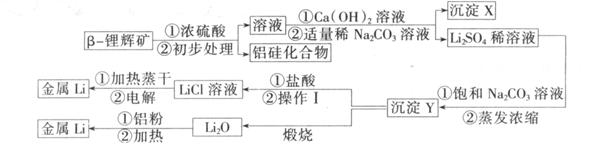
请回答:
(1)沉淀Y的主要成分的化学式是____________。
(2)流程中使用了不同浓度的Na2CO3溶液,从物质溶解度大小的角度解释其使用的原因____________
(3 )操作1涉及的实验方法是__________________。
(4 )写出用铝粉还原法制取金属锂的化学反应方程式。________________________
(5) LiCl溶液加热蒸干后,所得固体在熔融状态下电解制备锂。电解时产生的氯气中混有少量氧气,产生氧气的原因是__________________
(6) 目前电池通常使用金属锂的优点是__________________
(15分)1、下列有关元素锗及其化合物的叙述中正确的是 ___________
| A.锗的第一电离能高于碳而电负性低于碳 |
| B.四氯化锗与四氯化碳分子都是四面体构型 |
| C.二氧化锗与二氧化碳都是非极性的气体化合物 |
| D.锗和碳都存在具有原子晶体结构的单质 |
(15分)1、下列有关元素锗及其化合物的叙述中正确的是 ___________
A.锗的第一电离能高于碳而电负性低于碳
B.四氯化锗与四氯化碳分子都是四面体构型
C.二氧化锗与二氧化碳都是非极性的气体化合物
D.锗和碳都存在具有原子晶体结构的单质
2、铜在我国有色金属材料的消费中仅次于铝,广泛地应用于电气、机械制造、国防等领域。回答下列问题:
(1)铜原子基态电子排布式为 ;
(2)用晶体的x射线衍射法可以测得阿伏加德罗常数。对金属铜的测定得到以下结果:晶胞为面心立方最密堆积,边长为361pm。又知铜的密度为9.00g·cm-3,则阿伏加德罗常数为 (列式计算);
(3)氯和钾与不同价态的铜可生成两种化合物,这两种化合物都可用于催化乙炔聚合,其阴离子均为无限长链结构(如下图),a位置上Cl原子的杂化轨道类型为 。已知其中一种化合物的化学式为KCuCl3,另一种的化学式为 ;
(4)金属铜单独与氨水或单独与过氧化氢都不能反应,但可与氨水和过氧化氢的混合溶液反应,其原因是 ,反应的化学方应程式为 。
[化学一选修2:化学与技术](15分)已知:
①工业上用硫酸与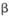 -锂辉矿(LiAlSi2O6和少量钙镁杂质)反应,生成Li2SO4、MgSO4 等,最终制备金属锂。
-锂辉矿(LiAlSi2O6和少量钙镁杂质)反应,生成Li2SO4、MgSO4 等,最终制备金属锂。
②氢氧化锂在一定温度下可转化为氧化锂。
用 -锂辉矿与硫酸等物质制备金属锂的工业流程如下图:
-锂辉矿与硫酸等物质制备金属锂的工业流程如下图:

请回答:
(1)沉淀Y的主要成分的化学式是____________。
(2)流程中使用了不同浓度的Na2CO3溶液,从物质溶解度大小的角度解释其使用的原因____________
(3 )操作1涉及的实验方法是__________________。
(4 )写出用铝粉还原法制取金属锂的化学反应方程式。________________________
(5) LiCl溶液加热蒸干后,所得固体在熔融状态下电解制备锂。电解时产生的氯气中混 有少量氧气,产生氧气的原因是__________________
(6) 目前电池通常使用金属锂的优点是__________________
(15分)某芳香烃A,分子式为C8H10;某烃类衍生物X,分子式为C15H14O3,能使FeCl3溶液显紫色:J分子内有两个互为对位的取代基。在一定条件下有如下的转化关系:(无机物略去)
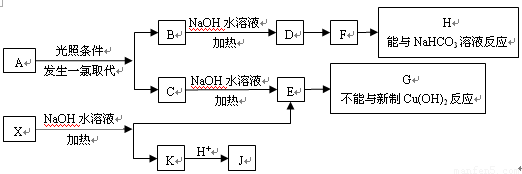
(1)①A物质的名称为:______。(2分) ②X E+K的反应类型是______。(2分)
(2)G、F中所含的含氧官能团的名称分别为___________、___________。(各1分)
(3)E与H反应的化学方程式是________________________________;(2分)
(4)B、C的混合物在NaOH乙醇溶液中加热可以生成同一种有机物I,
B→I的化学方程式________________________________________;(2分)
(5)已知J有多种同分异构体,符合下列性质的J的同分异构体共有_____种。(3分)
①与FeCl3溶液作用显紫色; ②与新制Cu(OH)2悬浊液作用产生红色沉淀;
③苯环上的一卤代物有2种。写出其中一种一氯代物的结构简式____________(2分)
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com