
题目列表(包括答案和解析)
现有A、B、C、D、E、F六种短周期元素,它们的原子序数依次增大,D与E的氢化物分子构型都是V型。A、B的最外层电子数之和与C的最外层电子数相等,A能分别与B、C、D形成电子总数相等的分子,且A与D可形成的化合物,常温下均为液态。
请回答下列问题(填空时用实际符号):
(1) C的元素符号是 ;元素F在周期表中的位置 。
(2) B与D一般情况下可形成两种常见气态化合物,假若现在科学家制出另一种直线型气态化合物 B2D2分子,且各原子最外层都满足8电子结构,则B2D2电子式为 ,其固体时的晶体类型是 。
(3) 最近意大利罗马大学的FuNvio Cacace等人获得了极具理论研究意义的C4分子。C4分子结构如图所示,已知断裂lmolC-C吸收167kJ热量,生成Imo1C=C放出942kJ热量。根据以上信息和数据,下列说法正确的是 。

① C4属于一种新型的化合物
② C4沸点比P4(白磷)低
③ lmol C4气体转变为C2吸收882kJ热量
④ C4与C2互为同素异形体
⑤ C4稳定性比P4(白磷)差
⑥ C4属于原子晶体
⑦ C4和P4 (白磷)的晶体都属于分子晶体
⑧ C4与C2互为同分异构体
(4) C与F两种元素形成一种化合物分子,各原子最外层达8电子结构,则该分子的结构式为 ,其空间构型为 。
(5) 为了除去化合物乙(A2ED4);)稀溶液中混有的A2ED3,常采用A2D2为氧化剂,发生反应的离子方程式为:
(6) E与F形成的化合物E2F2在橡胶工业上有重要用途,遇水易水解,其空间结构与A2D2极为相似。对此以下说法正确的是 。
a .E2F2的结构式为:F- E—E- F
b.E2F2为含有极性键 和非极性键的非极性分子
c. E2Br2与E2F2结构相似,熔沸点:E2Br2> E2F2
d. E2F2与H2O反应的化学方程式可能为:2 E2F2+2H2O=EO2↑+ 3E↓+4HF
(7) 举出一种事实说明E与F的非金属性强弱(用化学方程式或用语言文字表达均可):
| 元素 | Al | B | Be | C | Cl | F | Li |
| X | 1.5 | 2.0 | 1.5 | 2.5 | 2.8 | 4.0 | 1.0 |
| 元素 | Mg | Na | O | P | S | Si | Fe |
| X | 1.2 | 0.9 | 3.5 | 2.1 | 2.5 | 1.7 | 1.8 |


A、B、C、D均为中学化学中常见的单质或化合物,它们之间的关系如图所示(部分产物已略去)
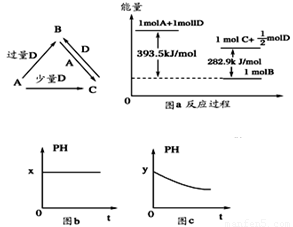
(1)若A为金属单质,D是某强酸的稀溶液,则反应C+D→B的离子方程式为_________
(2)若A、B为盐,D为强碱,A的水溶液显酸性,则 ①C的化学式为___________
②反应B+A→C的离子方程式为____________。
(3)若A为强碱,D为气态氧化物。常温时,将B的水溶液露置于空气中,其pH随时间t变化可能如上图的图b或图c所示(不考虑D的溶解和水的挥发)
①若图b符合事实,则D为________(填化学式),此时图b中x________7(填“﹥”“﹤”“=”)。②若图c符合事实,则其pH变化的原因是_______(用离子方程式表示)
(4)若A为非金属单质,D是空气的主要成分之一。它们之间转化时能量变化如上图a,请写出1molA和D反应生成C的反应热为ΔH=________________
V、W、X、Y、Z是五种常见元素,其中V、W、X、Y四种短周期元素在周期表中的位置如下图所示:V、W的最简单气态氢化物M、N混合时有白烟生成,M能使湿润的pH试纸变蓝。Z是人体血红蛋白中存在的金属元素。请填写下列空白:
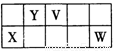
(1)W的原子结构示意图为 ;
(2)二氧化钛(TiO2)与X的单质、Y的单质高温下反应生成两种化合物,这两种化合物均由两种元素组成。其反应的化学方程式为 ;
(3)含X元素的一种化合物A与Y的最高价氧化物C之间有如下的反应关系:
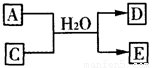
若E为白色沉淀,则E物质的化学式为 ;
(4)常温下,相同浓度 X、Z简单离子的溶液中滴加NaOH溶液,X、Z两元素先后沉淀,X(OH)n完全沉淀的pH是4.7,Z(OH)n完全沉淀的pH是2.8,则Ksp[X(OH)n] (填“>”或 “<”) Ksp[Z(OH)n];
(5)Y与氢能形成多种化合物,其中一种为Y2H2。2.00g Y2H2完全燃烧生成液态水和二氧化碳,放出99.6kJ热量,写出Y2H2燃烧的热化学反应方程式________________________________________________________;
(6)同温同压下,将a L M气体和b LN气体通入水中,若所得溶液的pH=7,则a b(填“>"或“<”或“=”)。
V、W、X、Y、Z是五种常见元素,其中V、W、X、Y四种短周期元素在周期表中的位置如下图所示:V、W的最简单气态氢化物M、N混合时有白烟生成,M能使湿润的pH试纸变蓝。Z是人体血红蛋白中存在的金属元素。请填写下列空白:
(1)W的原子结构示意图为 ;
(2)二氧化钛(TiO2)与X的单质、Y的单质高温下反应生成两种化合物,这两种化合物均由两种元素组成。其反应的化学方程式为 ;
(3)含X元素的一种化合物A与Y的最高价氧化物C之间有如下的反应关系:
若E为白色沉淀,则E物质的化学式为 ;
(4)常温下,相同浓度 X、Z简单离子的溶液中滴加NaOH溶液,X、Z两元素先后沉淀,X(OH)n完全沉淀的pH是4.7,Z(OH)n完全沉淀的pH是2.8,则Ksp[X(OH)n] (填“>”或 “<”) Ksp[Z(OH)n];
(5)Y与氢能形成多种化合物,其中一种为Y2H2。2.00g Y2H2完全燃烧生成液态水和二氧化碳,放出99.6kJ热量,写出Y2H2燃烧的热化学反应方程式________________________________________________________;
(6)同温同压下,将a L M气体和b LN气体通入水中,若所得溶液的pH=7,则a b(填“>"或“<”或“=”)。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com