
题目列表(包括答案和解析)
[选修—有机化学基础](15分)
有机物A、H、O分子式相同,经测定相对分子质量不超过110。分子中只含C、H、O三种元素,碳的百分含量为60%,其中A能发生银镜反应。A的碳链无支链;B分子中只有五元环。有关的转化关系如图24的示。请回答下列问题:
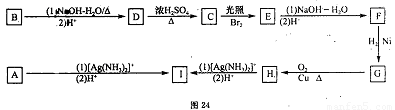
(1)写出B的结构简式 ;1分子核磁共振氢谱中有3种峰,其峰面积之比为1:2:1,I的名称是 。
(2)写出C—E反应类型是 ;F—G的反应类型是 。
(3)写出D—C、G—H的化学反应方程式。
D—C ;
G—H 。
(4)写出与B属地同分异构体,分子中有一个五元环且能与银氨溶液反应的结构简式
。
(16分)氯气是一种重要的化工原料,在工农业生产、生活中有着重要的应用。请你根据所学知识回答下列问题:
I、把氯气通入含淀粉碘化钾的溶液中,可观察到的现象是: ,
说明氯单质的氧化性 碘单质的氧化性。(填﹤,﹥,=)
Ⅱ、某化学兴趣小组计划用氯气和氢氧化钠制取简易消毒液。
(1)其反应原理为:(用离子方程式表示) 。
(2)实验室配制好4.0 mol·L-1的NaOH溶液,这种溶液需要 L才能与标准状况下2.24 L氯气恰好完全反应。
(3)配制250 mL 4.0mol·L-1NaOH溶液的实验步骤:
a、计算需要氢氧化钠固体的质量。
b、称量氢氧化钠固体。
c、将烧杯中的溶液注入容量瓶,并用少量蒸馏水洗涤烧杯内壁2~3次,洗涤液也注入250 mL容量瓶。
d、用适量蒸馏水溶解称量好的氢氧化钠固体,冷却。
e、盖好瓶塞,反复上下颠倒,摇匀。
f、继续向容量瓶中加蒸馏水至刻度线下1~2cm时,改用胶头滴管加蒸馏水至凹液面最低液而与刻度线相切。
①所需称量的氢氧化钠固体的质量是 。
②上述步骤的正确操作顺序是 。
③上述实验需要的仪器有:天平、药匙、烧杯、玻璃棒、 、 。
(15分)
(1)电解精炼铜阳极的主要反应是 ,还会发生的反应有 (任写一个)。
(2)电解精炼铜的阳极泥中含有铜和金、银等贵重金属及稀有金属。提炼阳极泥的方法有多种,湿法提炼是其中重要的一种,其主要生产流程如下:
请回答下列问题:
①各步生产流程中都涉及了同一种分离方法,实验室中不能用这种方法来分离液态胶体中分散质与分散剂的原因是 。
②用硝酸处理固体B中碳酸铅的离子方程式是 。
③反应I中肼(N2H4)的作用是 。
④固体C用盐酸、食盐和氯酸钠混合溶液处理后得到H2PtCl6、AuCl3、PdCl2。反应中每消耗lmol氧化剂要转移 mol e-;在AuCl3溶液中通入SO2生成单质金,当生成19.7gAu时,25℃和101kPa下反应消耗 L SO2(此条件下的气体摩尔体积为24.5L/mol)。
I.(8分)A、B、C、D四种短周期元素,原子序数依次增大,A原子的最外层上有5个电子;B的阴离子和C的阳离子具有相同的电子层结构,两元素的单质反应,生成一种淡黄色的固体E,D的L层电子数等于K、M两个电子层上的电子数之和。
(1)A的最高价氧化物的水化物是___________(填化学式);
(2)物质E中所包含的化学键有______________,写出C、D两元素形成的化合物C2D的电子式______________________;
(3)把盛有48 mL AB、AB2混合气体的容器倒置于水中(同温、同压下),待液面稳定后,容器内气体体积变为24 mL,则原混合气体中AB的体积分数为__________。
II.(6分)下表为长式周期表的一部分,其中的编号代表对应的元素。
请回答下列问题:
(1)写出元素⑩的基态原子的电子排布式_________________。
(2)某元素的特征电子排布式为nsnnpn+1,该元素原子的核外最外层电子的成对电子数为_____
(3)③④⑤三种元素的第一电离能由大到小的顺序是(填序号)___________。
(16分)氯气是一种重要的化工原料,在工农业生产、生活中有着重要的应用。请你根据所学知识回答下列问题:
I、把氯气通入含淀粉碘化钾的溶液中,可观察到的现象是: ,
说明氯单质的氧化性 碘单质的氧化性。(填﹤,﹥,=)
Ⅱ、某化学兴趣小组计划用氯气和氢氧化钠制取简易消毒液。
(1)其反应原理为:(用离子方程式表示) 。
(2)实验室配制好4.0 mol·L-1的NaOH溶液,这种溶液需要 L才能与标准状况下2.24 L氯气恰好完全反应。
(3)配制250 mL 4.0mol·L-1NaOH溶液的实验步骤:
a、计算需要氢氧化钠固体的质量。
b、称量氢氧化钠固体。
c、将烧杯中的溶液注入容量瓶,并用少量蒸馏水洗涤烧杯内壁2~3次,洗涤液也注入250 mL容量瓶。
d、用适量蒸馏水溶解称量好的氢氧化钠固体,冷却。
e、盖好瓶塞,反复上下颠倒,摇匀。
f、继续向容量瓶中加蒸馏水至刻度线下1~2cm时,改用胶头滴管加蒸馏水至凹液面最低液而与刻度线相切。
①所需称量的氢氧化钠固体的质量是 。
②上述步骤的正确操作顺序是 。
③上述实验需要的仪器有:天平、药匙、烧杯、玻璃棒、 、 。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com