(如图1)下表为周期表的一部分,表中所列的字母分别代表一种化学元素.

用化学用语回答下列问题:
(1)写出元素f的基态原子核外电子排布式
1s22s22p5
1s22s22p5
.
(2)在c
6a
6分子中,元素c为
sp2
sp2
杂化,该分子是
非极性
非极性
分子(填“极性”或“非极性”).
(3)ci
2分子的电子式为
,ci
2与ce
2比较,沸点较高的是
CS2
CS2
(写分子式).
(4)第一电离能:h
>
>
i;电负性:g
<
<
b(填“>”、“<”或“=”).
(5)下列关于元素在元素周期表中的位置以及元素原子的外围电子排布特点的有关叙正确是
AB
AB
.
A.j位于元素周期表中第四周期、ⅠB族,属于ds区元素
B.d的基态原子中,2p能级为半充满,属于p区元素
C.最外层电子排布式为4s
1,一定属于ⅠA族
D.最外层电子排布式为ns
2np
1,该元素可能是ⅢA族或ⅢB族
(6)将氨水滴入到j的硫酸盐溶液中,先产生蓝色沉淀,然后沉淀逐渐溶解并得到深蓝色溶液,显深蓝色的离子是
[Cu(NH3)4]2+
[Cu(NH3)4]2+
,写出蓝色沉淀溶解在氨水中的离子方程式
Cu(OH)2+4NH3?H2O=[Cu(NH3)4]2++2OH-+4H2O
Cu(OH)2+4NH3?H2O=[Cu(NH3)4]2++2OH-+4H2O
.
(7)j的金属晶体的晶胞如图2所示,则一个晶胞中j原子的个数是
4
4
个.



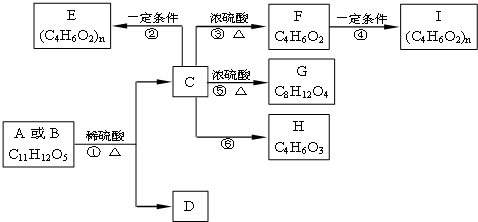
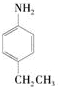
 是一种医药中间体,常用来制备抗凝血药,可通过下列路线合成:
是一种医药中间体,常用来制备抗凝血药,可通过下列路线合成: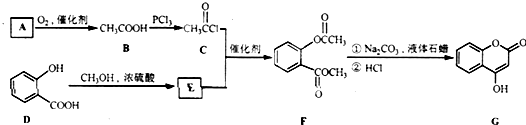




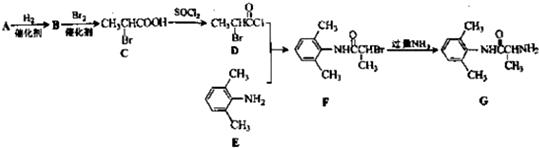
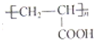 的单体,则A中含有的官能团是
的单体,则A中含有的官能团是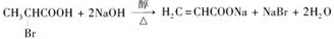
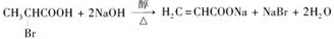
 、
、