
题目列表(包括答案和解析)
已知前四周期六种元素A、B、C、D、E、F的原子序数之和为107,且它们的核电荷数依次增大。B原子的p轨道半充满,其氢化物沸点是同族元素中最低的,D原子得到一个电子后3p轨道全充满,A与C能形成A2C型离子化和物,其中的阴、阳离子相差一个电子层,E4+离子和氩原子的核外电子排布相同。请回答下列问题:
(1)A、B、C、D的第一电离能由小到大的顺序是____________(填元素符号)
(2)化合物BD3的分子空间构型可描述为_________,B的原子轨道杂化类型为________。
(3)已知F元素在人体内含量偏低时,会影响O2在体内的正常运输。已知F2+与KCN溶液反应得F(CN)2沉淀,当加入过量KCN溶液时沉淀溶解,生成配合物。则F的基态原子价电子排布式为______。CN-与___________(一种分子)互为等电子体,则1个CN-中π键数目为___________。
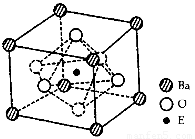
(4)EO2与碳酸钡在熔融状态下反应,所得晶体的晶胞结构如图所示,则该反应的化学方程式为________
在该晶体中,E4+的氧配为数为____________。若该晶胞边长为a nm可 计算该晶体的密度为__________g/cm3(阿伏加德罗常数为NA)
三聚氰胺的结构简式如右:
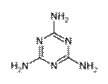 ⑴三聚氰胺的分子式为____________;分子中碳原子的杂化方式是______;分子中处于同一平面的氮原子有______个。
⑴三聚氰胺的分子式为____________;分子中碳原子的杂化方式是______;分子中处于同一平面的氮原子有______个。
⑵三聚氰胺的水溶液呈弱碱性,其原因是_______________________________________。
⑶三聚氰胺在高温下可释放氰化物,六氰合亚铁离子[Fe(CN)64-]中也含有CN-,写出一种与CN-互为等电子体的单质分子的路易斯结构式________________。
⑷三聚氰胺性状为纯白色单斜棱晶体,无味,密度1.573 g/cm3 (16 ℃)。常压熔点354 ℃(分解);快速加热升华,升华温度300 ℃。据此可判断三聚氰胺的晶体类型应为______________晶体。
⑸蛋白质的基本结构单元为氨基酸,其含氮量一般不超过30%,由于食品和饲料工业蛋白质含量测试方法的缺陷(以测定含氮量来确定蛋白质的含量),故三聚氰胺被不法分子用作食品添加剂,以提高食品检测中的蛋白质含量指标,故三聚氰胺被人称为“蛋白精”。通过计算说明三聚氰胺被称为蛋白精的理由。
(1)CH3+ 、-CH3(甲基)、CH3-都是重要的有机反应中间体,有关它们的说法正确的是
A.它们均由甲烷去掉一个氢原子所得
B.它们互为等电子体,碳原子均采取sp2杂化
C.CH3-与NH3、H2O+互为等电子体,几何构型均为三角锥形
D.CH3+中的碳原子采取sp2杂化,所有原子均共面
E.两个-CH3(甲基)或一个CH3+和一个CH3-结合均可得到CH3CH3
(2)锌是一种重要的金属,锌及其化合物有着广泛的应用。
①锌在元素周期表中的位置是:_ 。
②葡萄糖酸锌[CH2OH(CHOH)4COO]2Zn是目前市场上流行的补锌剂。写出Zn2+基态电子排布式 ,葡萄糖分子[CH2OH(CHOH)4CHO]中碳原子杂化方式有 。
③Zn2+能与NH3形成配离子[Zn(NH3)4]2+。配位体NH3分子属于 (填“极性分子”或“非极性分子”);在〔Zn(NH3)4]2+中,Zn2+位于正四面体中心,N位于正四面体的顶点,试在左下图中表示出[Zn(NH3)4]2+中Zn2+与N之间的化学键。
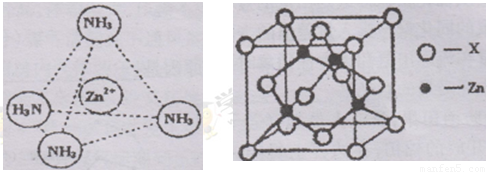
④右上图示锌与某非金属元素X形成的化合物晶胞,其中Zn和X通过共价键结合,该化合物的Zn与X的原子个数之比为 。
⑤在④的晶胞(右上图)中,如果只考查X的排列方式,则X的堆积方式属于金属晶体堆积方式中的___ 堆积;设该晶胞中Zn的半径为r1 cm,其相对原子质量为M1,X的半径为r2cm,其相对原子质量为M2,则该晶体的密度为_ g/cm3 (写出含有字母的表达式)。
如下图,直线交点处的圆圈为NaCl晶体中Na+离子或Cl-离子所处的位置.这两种离子在空间三个互相垂直的方向上都是等距离排列的.
(1)请将其中代表Na+离子的圆圈涂黑(不必考虑体积大小),以完成NaCl晶体结构示意图.
(2)晶体中,在每个Na+离子的周围与它最接近的且距离相等的Na+共有________个.
(3)晶体中每一个重复的结构单元叫晶胞.在NaCl晶胞中正六面体的顶点上,面上,棱上的Na+或Cl-为该晶胞与其相邻的晶胞所共有.一个晶胞中,Cl-离子的个数等于________,即________(填计算式),Na+离子的个数等于________,即________(填计算式).
(4)设NaCl的摩尔质量为Mg/mol,食盐晶体的密度为ρg/cm3,阿伏伽德罗常数为NA.食盐晶体中两个距离最近的钠离子中心间的距离为________cm.

(1)请将其中代表Na+离子的圆圈涂黑(不必考虑体积大小),以完成NaCl晶体结构示意图.
(2)晶体中,在每个Na+离子的周围与它最接近的且距离相等的Na+共有________个.
(3)晶体中每一个重复的结构单元叫晶胞.在NaCl晶胞中正六面体的顶点上,面上,棱上的Na+或Cl-为该晶胞与其相邻的晶胞所共有.一个晶胞中,Cl-离子的个数等于________,即________(填计算式),Na+离子的个数等于________,即________(填计算式).
(4)设NaCl的摩尔质量为Mg/mol,食盐晶体的密度为pg/cm3,阿伏伽德罗常数为![]() .食盐晶体中两个距离最近的钠离子中心间的距离为________cm.
.食盐晶体中两个距离最近的钠离子中心间的距离为________cm.

湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com