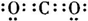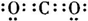(1)写出下列物质在水中电离的方程式:
①亚硫酸
H2SO3?H++HSO3-,HSO3-?H+SO3-
H2SO3?H++HSO3-,HSO3-?H+SO3-
;
②氢氧化铁
Fe(OH)3?Fe3++3OH-
Fe(OH)3?Fe3++3OH-
;
③碳酸氢钾
KHCO3=K++HCO3-,HCO3-?H++CO32-
KHCO3=K++HCO3-,HCO3-?H++CO32-
;
④硫酸氢钾
KHSO4=K++H++SO42-
KHSO4=K++H++SO42-
.
(2)写出下列盐溶于水时水解的离子方程式:
①Al
2S
32Al3++3S2-+6H2O=2Al(OH)3↓+3H2S↑
2Al3++3S2-+6H2O=2Al(OH)3↓+3H2S↑
;
②FeCl
3Fe3++3H2O?Fe(OH)3+3H+
Fe3++3H2O?Fe(OH)3+3H+
;
③K
2CO
3CO32-+H2O?HCO3-+OH-,HCO3-+H2O?H2CO3+OH-
CO32-+H2O?HCO3-+OH-,HCO3-+H2O?H2CO3+OH-
;
④CuSO
4Cu2++2H2O?Cu(OH)2+2H+
Cu2++2H2O?Cu(OH)2+2H+
;
⑤CH
3COONH
4NH4++CH3COO-?CH3COOH+NH3?H2O
NH4++CH3COO-?CH3COOH+NH3?H2O
.
(3)25℃时,pH=2的酸(HA)溶液和pH=12的碱(BOH)溶液等体积混合,混合溶液的pH=5.写出混合溶液中所发生水解反应的离子方程式
A-+H2O?HA+OH-
A-+H2O?HA+OH-
(4)向NaHSO
4溶液中,逐滴加入Ba(OH)
2溶液至中性,写出此反应的离子反应方程式
Ba2++2OH-+2H++SO42-=BaSO4↓+2H2O
Ba2++2OH-+2H++SO42-=BaSO4↓+2H2O
;
在以上中性溶液中继续滴加Ba(OH)
2溶液,写出此反应的离子反应方程式
Ba2++SO42-=BaSO4↓
Ba2++SO42-=BaSO4↓
.

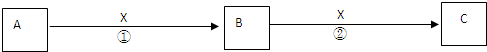
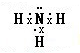




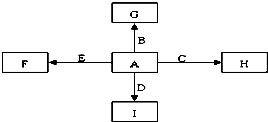 A、B、C、D、E是单质,G、H、I、F是B、C、D、E分别和A形成的二元化合物.已知:
A、B、C、D、E是单质,G、H、I、F是B、C、D、E分别和A形成的二元化合物.已知: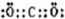
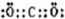
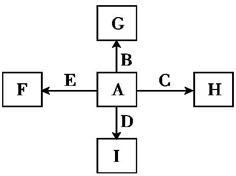 如图所示中,A、B、C、D、E是单质,G、H、I、F是B、C、D、E分别和A形成的二元化合物.已知:
如图所示中,A、B、C、D、E是单质,G、H、I、F是B、C、D、E分别和A形成的二元化合物.已知: