
题目列表(包括答案和解析)
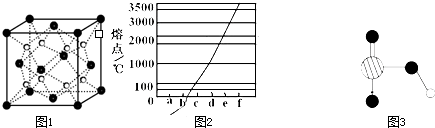
 某同学在研究前18号元素时发现,可以将它们排成如图所示的“蜗牛”形状,图中每个弧线上的“?”代表一种元素,其中起点O代表氢元素.下列说法中正确的是( )
某同学在研究前18号元素时发现,可以将它们排成如图所示的“蜗牛”形状,图中每个弧线上的“?”代表一种元素,其中起点O代表氢元素.下列说法中正确的是( )| A、离O点越远的元素原子半径越大 | B、虚线相连的元素处于同一族 | C、最简单氢化物的热稳定性:A>C>D | D、A、B两种元素组成的化合物中不可能含有共价键 |
某同学在研究前18号元素时发现,可以将它们排成如图所示的“蜗牛”形状,图中每个弧线上的“·”代表一种元素,其中起点O代表氢元素。下列说法中正确的是

A.离O点越远的元素原子半径越大
B.虚线相连的元素处于同一族
C.最简单氢化物的热稳定性:A>C>D
D.A、B两种元素组成的化合物中不可能含有共价键
某同学在研究前18号元素时发现,可以将它们排成如图所示的“蜗牛”形状,图中每个弧线上的“·”代表一种元素,其中起点O代表氢元素。下列说法中正确的是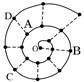
A.离O点越远的元素原子半径越大
B.虚线相连的元素处于同一族
C.最简单氢化物的热稳定性:A>C>D
D.A、B两种元素组成的化合物中不可能含有共价键
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com