
题目列表(包括答案和解析)
(8分)(1)在调水工程中,沿途工业污水的任意排放是造成水质恶化的最大原因。经检测某工厂废液中含有大量Mg2+、Al3+、Ag+,Fe3+、Ba2+。试分析回答下列问题:
①该废液中可能大量存在的一种阴离子是____(填序号)。
A.SO B.NO C.Cl- D.CO
②为了充分利用资源和保护环境,今要回收废液中的金属银,请你设计一个回收实验方案,并写出有关离子反应方程式: ____________________________________________
________________________________________________________________________。
(2)节能减排是中国政府报告中的关键词。火力发电厂为了减少二氧化硫的排放,往往对煤炭进行脱硫处理,而脱硫的方法有多种,下面是一种常用的脱硫方法:
微生物脱硫技术:煤炭中的硫是以FeS2存在的,在水和空气存在的条件下,脱硫微生物起生物催化作用:
①2FeS2+7O2+2H2O  4H++2Fe2++4SO42—;
4H++2Fe2++4SO42—;
②4Fe2++O2+4H+ 4Fe3++2H2O;
4Fe3++2H2O;
③FeS2+2Fe3+ 3Fe2++2S;
3Fe2++2S;
④2S+3O2+2H2O 4H++2SO42—。
4H++2SO42—。
在微生物脱硫的反应中,FeS2最终被________氧化,转化为________(填化学式)而除去;反应③中若生成0.2 mol S,则转移的电子为________mol。
(8分)目前世界上比较先进的电解制碱技术是离子交换法,如图为离子交换膜法电解饱和食盐水的原理示意图。
(1)下列说法不正确的是
A.从E口逸出的气体是H2
B.从B口加入含少量NaOH的水溶液以增强导电性
C.标准状况下每生成22.4 L Cl2,便产生2 mol NaOH
D.粗盐水中含Ca2+、Mg2+、Fe3+、SO42-等离子,精制时先加 Na2CO3溶液
(2)现有离子交换膜A和B将电解槽分为I、II、III三个区域(下图所示),在这种电解池中电解Na2SO4溶液可制得氢氧化钠、硫酸等物质。A为 离子交换膜、B为 离子交换膜(填“阴”或“阳”),电极均为惰性电极。Na2SO4溶液应该在 区(填“I”、“II”、“III”)加入。通电电解时阴极的电极反应式为 ,在III区得到 。当外电路总共通过30 mol电子时,生成的NaOH 960克,则电解过程中能量的转化率为:
(8分)目前世界上比较先进的电解制碱技术是离子交换法,如图为离子交换膜法电解饱和食盐水的原理示意图。
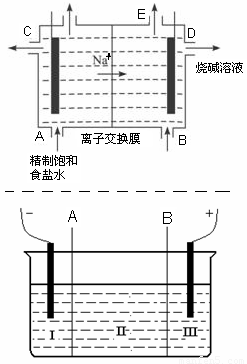
(1)下列说法不正确的是
A.从E口逸出的气体是H2
B.从B口加入含少量NaOH的水溶液以增强导电性
C.标准状况下每生成22.4 L Cl2,便产生2 mol NaOH
D.粗盐水中含Ca2+、Mg2+、Fe3+、SO42-等离子,精制时先加 Na2CO3溶液
(2)现有离子交换膜A和B将电解槽分为I、II、III三个区域(下图所示),在这种电解池中电解Na2SO4溶液可制得氢氧化钠、硫酸等物质。A为 离子交换膜、B为 离子交换膜(填“阴”或“阳”),电极均为惰性电极。Na2SO4溶液应该在 区(填“I”、“II”、“III”)加入。通电电解时阴极的电极反应式为 ,在III区得到 。当外电路总共通过30 mol电子时,生成的NaOH 960克,则电解过程中能量的转化率为:
(8分)煤炭中以FeS2形式存在的硫,在有水和空气及在脱硫微生物存在下发生生物氧化还原反应,有关反应的离子方程式依次为:
①2FeS2+7O2+2H2O 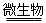 4H++2Fe2++________;
4H++2Fe2++________;
②4Fe2++O2+4H+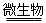 4Fe3++____________;
4Fe3++____________;
③FeS2+2Fe3+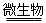 3Fe2++2S;
3Fe2++2S;
④2S+3O2+2H2O 4H++2SO42—。
4H++2SO42—。
已知:FeS2中的铁元素为+2价。
回答下列问题:
(1)根据质量守恒定律和电荷守恒定律,将上述①②离子方程式补充完整。
(2)反应③的还原剂是________________。
(3)观察上述反应,FeS2最终转化为____________从煤炭中分离出来。
(8分)煤炭中以FeS2形式存在的硫,在有水和空气及在脱硫微生物存在下发生生物氧化还原反应,有关反应的离子方程式依次为:
①2FeS2+7O2+2H2O  4H++2Fe2++________;
4H++2Fe2++________;
②4Fe2++O2+4H+ 4Fe3++____________;
4Fe3++____________;
③FeS2+2Fe3+ 3Fe2++2S;
3Fe2++2S;
④2S+3O2+2H2O 4H++2SO42—。
4H++2SO42—。
已知:FeS2中的铁元素为+2价。
回答下列问题:
(1)根据质量守恒定律和电荷守恒定律,将上述①②离子方程式补充完整。
(2)反应③的还原剂是________________。
(3)观察上述反应,FeS2最终转化为____________从煤炭中分离出来。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com