
题目列表(包括答案和解析)
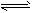 2NH3(g) 已知298K时:正反应的△H=-92.4KJ/mol,△S=-198.2J/mol/K。
2NH3(g) 已知298K时:正反应的△H=-92.4KJ/mol,△S=-198.2J/mol/K。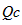 )
)德国人哈伯在1905年发明的合成氨,其反应原理为:N2(g)+3H2(g) ![]() 2NH3(g)
2NH3(g)
已知298K时:正反应的△H= —92.4KJ/mol, △S= —198.2J/mol/K.试回答下列问题:
(1)根据正反应的焓变和熵变判断298K下合成氨反应________(填“能”或“不能”)自发进行。
(2)加压平衡向正反应方向移动,该反应平衡常数K (填“变”或“不变”),当浓度商(![]() ) 化学平衡常数(Kc)(填“大于”、“等于”、“小于”)时,反应向右进行。
) 化学平衡常数(Kc)(填“大于”、“等于”、“小于”)时,反应向右进行。
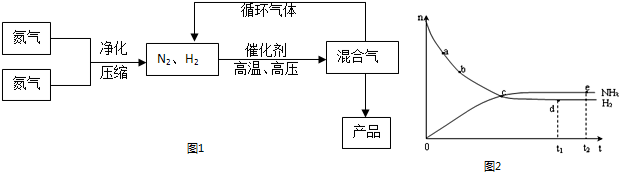
(3)在实际工业合成氨生产中采取的措施是 (填序号)。
A采用较低压强
B采用700K左右的高温
C用铁触媒作催化剂
D将生成的氨液化并及时分离出来,未反应的![]() 和
和![]() 重新循环到合成塔中
重新循环到合成塔中
氨是一种重要的基础化工原料,可以生产硝酸等一系列化工产品。德国人哈伯在1905年发明的合成氨反应原理为:
![]()
![]() ;
;![]()
回答下列问题:
(1)将10mol ![]() 和30mol
和30mol ![]() 装入密闭容器中,在一定条件下反应达到平衡,若有15%的
装入密闭容器中,在一定条件下反应达到平衡,若有15%的![]() 转化,则反应放出的热量是_______________kJ。
转化,则反应放出的热量是_______________kJ。
(2)工业合成氨生产中采取的措施是____________(填序号)
A. 采用较低压强
B. 采用700K左右的高温
C. 用铁触媒作催化剂
D. 将氨液化及时从混合物中分离,![]() 循环到合成塔中,并补充
循环到合成塔中,并补充![]()
(3)用下图所示装置(夹持固定装置已略去)在实验室中模拟工业制![]()

回答下列问题:
①实验时,A装置中盛放的试剂是__________________________;
装置B中反应的化学方程式为_______________________________________;
②C装置中盛放的试剂是_______________________________________;
该物质的主要作用是_______________________________________;
D装置的作用是_______________________________________;
③若将上图所示装置中虚线部分换成下图所示装置进行实验。反应开始前,分液漏斗中盛放的药品是______________________;烧瓶中盛放的药品是_____________________。

| |||||||||||||||
| 气体 | 氮气 | 氢气 | 氨 |
| 熔点(℃) | -210.01 | -252.77 | -77.74 |
| 沸点(℃) | -195.79 | -259.23 | -33.42 |
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com