
题目列表(包括答案和解析)
(12分)某校化学实验兴趣小组在“探究卤素单质的氧化性”的系列实验中发现:在足量的稀氯化亚铁溶液中,加入1~2滴溴水,振荡后溶液呈黄色。
(1)提出问题:Fe3+、Br2哪一个的氧化性更强?
(2)猜想
①甲同学认为氧化性:Fe3+>Br2,故上述实验现象不是发生化学反应所致,则溶液呈黄色是含________(填化学式,下同)所致。
②乙同学认为氧化性:Br2>Fe3+,故上述实验现象是发生化学反应所致,则溶液呈黄色是含__________所致。
(3)设计实验并验证
丙同学为验证乙同学的观点,选用下列某些试剂设计出两种方案进行实验,并通过观察实验现象,证明了乙同学的观点确实是正确的。供选用的试剂:
a.酚酞试液 b.CCl4 c.无水酒精 d.KSCN溶液
请你在下列表格中写出丙同学选用的试剂及实验中观察到的现象。(试剂填序号)
| | 选用试剂 | 实验现象 |
| 方案1 | | |
| 方案2 | | |
1. (12分)某校化学实验兴趣小组在“探究卤素单质的氧化性”的系列实验中发现:在足量的稀氯化亚铁溶液中,加入1~2滴溴水,振荡后溶液呈黄色。
(1)提出问题:Fe3+、Br2哪一个的氧化性更强?
(2)猜想
①甲同学认为氧化性:Fe3+>Br2,故上述实验现象不是发生化学反应所致,则溶液呈黄色是含________(填化学式,下同)所致。
②乙同学认为氧化性:Br2>Fe3+,故上述实验现象是发生化学反应所致,则溶液呈黄色是含__________所致。
(3)设计实验并验证
丙同学为验证乙同学的观点,选用下列某些试剂设计出两种方案进行实验,并通过观察实验现象,证明了乙同学的观点确实是正确的。供选用的试剂:
a.酚酞试液 b.CCl4 c.无水酒精 d.KSCN溶液
请你在下列表格中写出丙同学选用的试剂及实验中观察到的现象。(试剂填序号)
|
| 选用试剂 | 实验现象 |
| 方案1 |
|
|
| 方案2 |
|
|
(4)应用与拓展
①在足量的稀氯化亚铁溶液中加入1~2滴溴水,溶液呈黄色,所发生的离子反应方程式为
_______________________________________________________________________。
②在100 mL FeBr2溶液中通入2.24 L Cl2(标准状况),溶液中有1/3的Br-被氧化成单质Br2,则原FeBr2溶液中FeBr2的物质的量浓度为_____________________。
1. (12分)某校化学实验兴趣小组在“探究卤素单质的氧化性”的系列实验中发现:在足量的稀氯化亚铁溶液中,加入1~2滴溴水,振荡后溶液呈黄色。
(1)提出问题:Fe3+、Br2哪一个的氧化性更强?
(2)猜想
①甲同学认为氧化性:Fe3+>Br2,故上述实验现象不是发生化学反应所致,则溶液呈黄色是含________(填化学式,下同)所致。
②乙同学认为氧化性:Br2>Fe3+,故上述实验现象是发生化学反应所致,则溶液呈黄色是含__________所致。
(3)设计实验并验证
丙同学为验证乙同学的观点,选用下列某些试剂设计出两种方案进行实验,并通过观察实验现象,证明了乙同学的观点确实是正确的。供选用的试剂:
a.酚酞试液 b.CCl4 c.无水酒精 d.KSCN溶液
请你在下列表格中写出丙同学选用的试剂及实验中观察到的现象。(试剂填序号)
|
|
选用试剂 |
实验现象 |
|
方案1 |
|
|
|
方案2 |
|
|
(4)应用与拓展
①在足量的稀氯化亚铁溶液中加入1~2滴溴水,溶液呈黄色,所发生的离子反应方程式为
_______________________________________________________________________。
②在100 mL FeBr2溶液中通入2.24 L Cl2(标准状况),溶液中有1/3的Br-被氧化成单质Br2,则原FeBr2溶液中FeBr2的物质的量浓度为_____________________。
(12分)I.下列是四组同学用铜制取硫酸铜晶体的方案:
甲组:将铜粉投入盛有稀硫酸的容器中,无反应。向容器底部缓缓鼓入氧气,溶液慢慢变蓝色,若在溶液中放置些铂丝,反应速率明显加快。
![]()
![]() 乙组: Cu CuO CuSO4
乙组: Cu CuO CuSO4
![]()
![]()
![]() 丙组: Cu Cu(NO3)2 Cu(OH)2 CuSO4
丙组: Cu Cu(NO3)2 Cu(OH)2 CuSO4
![]() 丁组: Cu CuSO4
丁组: Cu CuSO4
(1)甲组实验用一个化学反应方程式表示: ;
使反应变快的可能原因是 ;从该反应器溶液(含有少量H2SO4以抑制水解)中取得产品的实验操作步骤应为 、
过滤并洗涤晶体,取得产品后的残留物质可循环使用。
(2)可持续发展的原则要求化工生产①原理科学;②能量消耗低;③原料利用率高;④无污染。则在四组方案中, 组方案最好。
II.另一化学兴趣小组从化学手册上查得硫酸铜500℃以上按照下式分解:
CuSO4![]() CuO+SO2↑+SO3↑+O2↑
CuO+SO2↑+SO3↑+O2↑
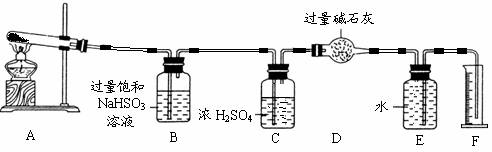 为此他们设计了如下图所示实验装置测定有关数据,并经计算确定该条件下CuSO4分解反应方程式中各物质的化学计量数。
为此他们设计了如下图所示实验装置测定有关数据,并经计算确定该条件下CuSO4分解反应方程式中各物质的化学计量数。
实验测得数据及有关结果如下;
①准确称取4.80g无水CuSO4;
②实验结束时干燥管D总质
量增加1.92g;③测得量筒F中水的体积,得出气体在标准状况下的体积为224.0mL。试回答下列问题:
(3)装置B的作用是 。
(4)装置C的作用是 。
(5)为减少测量气体体积引起的误差,应注意的事项有:
① 装置内气体的温度应恢复到室温,
② 调节量筒使其液面与E装置中的液面持平,
③ 。
(6)通过计算,推断出该条件下反应的化学方程式
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com