
题目列表(包括答案和解析)
(共10分) G 是一种医药中间体,常用来制备抗凝血药,可通过下列路线合成:
(1)A与银氨溶液反应有银镜生成,则A的分子式是________。(1分)
(2)B―→ C的反应类型是________。(1分)
(3)C与E反应生成F的化学方程式________________________________(2分)
(4)F的一种同分异构体能水解且苯环上的一氯代物有一种,任意写出其中一种的结构简式________。(2分)
(5)写出F和过量NaOH溶液共热时反应的化学方程式:
__________________________________________________________。(2分)
(6)下列关于G的说法正确的是________。(2分)
a.能与金属钠反应
b.1 mol G最多能和5 mol氢气反应
c.分子式是C9H6O3
d.1molG最多和3molNaOH反应
(10分)火药是中国的“四大发明”之一,永远值得炎黄子孙骄傲,也永远会激励着我们去奋发图强。黑火药在发生爆炸时,发生如下的反应:2KNO3+C+S===K2S+2NO2↑+CO2↑,此反应中的氧化剂是 ,还原剂是 (均用化学式填写)。当参加反应的S的质量为48g时,爆炸生成的气体折算成标准状况的体积为 。氧化还原反应的本质是反应中有电子转移,小明同学对这个重要知识点掌握的不是很理想,他很苦恼。请你写出一个你所熟悉的氧化还原反应的方程式,并标出电子转移的方向和数目,帮助小明同学彻底掌握这个知识点。
(10分)氮是地球上含量丰富的一种元素,氮及其化合物在工农业生产、生活中有着重要作用。请回答下列问题:
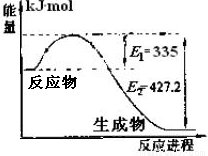
(1)右图是N2和H2反应生成2molNH3过程中能量变化示意图,请计算每生成1molNH3放出热量为 。
(2)在固定体积的密闭容器中,进行如下化学反应:N2(g)+3H2(g) 2NH3(g),其化学平衡常数K与t的关系如下表:
2NH3(g),其化学平衡常数K与t的关系如下表:
|
t/K |
298 |
398 |
498 |
…… |
|
K/(mol·L—1)—2 |
4.1×106 |
K1 |
K2 |
…… |
请完成下列问题:
①试比较K1、K2的大小,K1 K2(填写“>”“=”或“<”)
②下列各项能作为判断该反应达到化学平衡状态的依据的是 (填序号字母)。
A.容器内N2、H2、NH3的浓度之比为1:3:2 B.2v(N2)(正)= v(H2)(逆)
C.容器内压强保持不变 D.混合气体的密度保持不变
(3)盐酸肼(N2H6Cl2)是一种重要的化工原料,属于离子化合物,易溶于水,溶液呈酸性,水解原理与NH4Cl类似。
①写出盐酸肼第一步水解反应的离子方程式 。
②盐酸肼水溶液中离子浓度的关系表示正确的是 (填序号)。
A.c(Cl—)>c(N2H62+)>c(H+)>c(OH—)
B.c(Cl—)>c([N2H5·H2O]+)>c(OH—)>c(H+)
C.2c(N2H62+)+c([N2H5·H2O]+)+ c(H+) = c(Cl—)+c(OH—)
D.c(N2H62+) > c(Cl—)> c(H+) >c(OH—)
(10分)痛风是关节炎反复发作及产生肾结石为特征的一类疾病,关节炎的原因归结于在关节滑液中形成了尿酸钠(NaUr)晶体,有关平衡如下:①HUr(尿酸,aq)Ur-(尿酸根,aq)+H+(aq) (37℃时,Ka=4.0×10—6) ②NaUr(s)
Ur-(aq)+Na+(aq)
(1)37°时,1.0 L水中可溶解8.0×10-3mol尿酸钠,此温度下尿酸钠的Ksp为________。
(2)关节炎发作大都在脚趾和手指的关节处,这说明温度降低时,反应②的Ksp________(填“增大”、“减小”或“不变”),生成尿酸钠晶体的反应是________(填“放热”或“吸热”)反应。
(3)37℃时,某病人尿液中尿酸分子和尿酸根离子的总浓度为2.0×10-3mol·L—1,其中尿酸分子的浓度为5.0×10—4mol·L—1,该病人尿液的c(H+)为 ,PH 7(填“>”、“=”或“<”)。
(每空1分 共10分) 氮是地球上极为丰富的元素。
(1) Li3N晶体中氮以N3-的存在,基态N3-的电子排布图为 。
(2)N≡N的键能为942 kJ·mol-1,N–N单键的键能为247 kJ·mol-1,计算说明N2中的 键比 键稳定(填“σ”或“π”)。
(3)(CH3)3NH+和AlCl4-可形成离子液体。离子液体由阴、阳离子组成,熔点低于100℃,其挥发性一般比有机溶剂 (填“大”或“小”),可用作 。(填代号)
a.助燃剂 b.“绿色”溶剂 c.复合材料 d.绝热材料
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com