
题目列表(包括答案和解析)
已知阿伏加德罗常数约为6.02×1023mol-1,下列说法正确的是
A.标准状况下,16g 14CH4所含中子数为8×6.02×1023
B.1L0.5mol/L的CH3COONa溶液中含有的CH3COO-数为0.5×6.02×1023
C.常温常压下,16g氧气和32g臭氧所含氧原子总数为3×6.02×1023
D.6.2g白磷中所含的P-P键的个数为0.2×6.02×1023
|
已知阿伏加德罗常数的数值约为 6.02×1023,下列叙述正确的是 | |
| [ ] | |
A. |
48 g O3气体含有6.02×1023个O3分子 |
B. |
常温常压下, 11.2 L N2含有0.5×6.02×1023个N2分子 |
C. |
常温常压下, 0.1 mol/L CuCl2溶液中含有0.1×6.02×1023个Cu2+ |
D. |
标准状况下, 1 L水含有 |
铜单质及其化合物在很多领域中都有重要的用途。请回答以下问题:
(1)超细铜粉可用作导电材料、催化剂等,其制备方法如下:
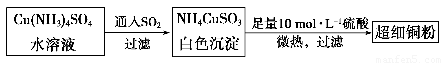
①NH4CuSO3中金属阳离子的核外电子排布式为______。N、O、S三种元素的第一电离能大小顺序为_______________________(填元素符号)。
②SO42-的空间构型为________。
(2)某学生用硫酸铜溶液与氨水做了一组实验,CuSO4溶液中加氨水生成蓝色沉淀,再加氨水沉淀溶解,得到深蓝色透明溶液,最后向该溶液中加入一定量乙醇,析出[Cu(NH3)4]SO4·H2O晶体,请解释加入乙醇后析出晶体的原因______________________;在该晶体中存在的化学键的种类有_____________。
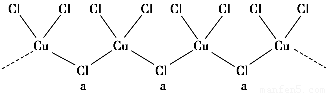
(3)氯和钾与不同价态的铜可生成两种化合物,其阴离子均为无限长链结构(如图所示),a位置上Cl原子的杂化轨道类型为________。已知其中一种化合物的化学式为KCuCl3,则另一种化合物的化学式为____________。
用晶体的X射线衍射法可以测得阿伏加德罗常数的值。对金属铜的测定得到以下结果:铜晶胞为面心立方最密堆积,边长为361 pm。又知铜的密度为9.00 g·cm-3,则铜原子的直径约为__________pm,阿伏加德罗常数的值为________[已知Ar(Cu)=63.6]。
设NA是阿伏加德罗常数的值,下列说法正确的是
A.1mol硫与1mol铜在加热条件下充分反应转移电子数为NA
B.已知2CO(g)+O2(g)  2CO2(g); △H=-akJ﹒mol-1 将2NA个CO与NA个O2混合充分反应放出akJ的热量。
2CO2(g); △H=-akJ﹒mol-1 将2NA个CO与NA个O2混合充分反应放出akJ的热量。
C.分子数为NA的CO、C2H4混合气体体积约为22.4 L,质量为28 g
D.3.4 g NH3中含N—H键数目为0.2 NA
NA代表阿伏加德罗常数,下列说法正确的是:( )
A.分子数为NA的CO、C2H4混合气体体积约为22.4 L,质量为28 g
B.已知2CO(g)+O2(g)
 2CO2(g);△H=-akJ﹒mol-1 将2NA个CO与NA个O2混合充分反应放出akJ的热量。
2CO2(g);△H=-akJ﹒mol-1 将2NA个CO与NA个O2混合充分反应放出akJ的热量。
C.用石灰乳完全吸收l mol Cl2时,转移电子的数目是NA
D.常温下,0.1mol/LNa2CO3溶液中,含有阴离子的总数大于0.1NA
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com