
题目列表(包括答案和解析)
 Ni(CO)4(g) 该反应的△H
Ni(CO)4(g) 该反应的△H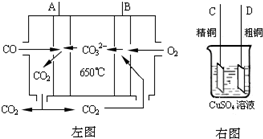
| 10 |
| 11 |
| ||
| 氢离子 |
| 石灰水 |

| ||
| ||
| O | 2- 4 |
| O | 2- 7 |
| O | 2- 7 |
(13分)Ⅰ.一氧化碳是一种用途相当广泛的化工基础原料。
(1)利用下列反应可以将粗镍转化为纯度达99.9%的高纯镍。
Ni(s)+4CO(g) Ni(CO)4(g) 该反应的ΔH ▲ 0 (选填“>”或“=”或“<”)。
Ni(CO)4(g) 该反应的ΔH ▲ 0 (选填“>”或“=”或“<”)。
(2)在高温下一氧化碳可将二氧化硫还原为单质硫。已知:
C(s)+O2(g)=CO2(g) ΔH1=-393.5 kJ·mol-1
CO2(g)+C(s)=2CO(g) ΔH2=+ 172.5 kJ·mol-1
S(s)+O2(g)=SO2(g) ΔH3=-296.0 kJ·mol-1
请写出CO除SO2的热化学方程式 ▲ 。
(3)下图中左图是一碳酸盐燃料电池,它以CO为燃料,一定比例Li2CO3和Na2CO3低熔混合物为电解质,右图是粗铜精炼的装置图,现用燃料电池为电源进行粗铜的精炼实验。回答下列问题:
①写出A极发生的电极反应式 ▲ 。
②要用燃料电池为电源进行粗铜的精炼实验,则B极应该与▲ 极(填:“C”或“D”)相连。
③当消耗2.24 L(标况下)CO时,粗铜电极理论上减少铜的质量 ▲ (填:“大于”、“等于” 或“小于”)6.4克。
Ⅱ.(1)已知Na2CrO4溶液酸化时发生的反应为:2CrO42-+2H+ Cr2O72-+H2O,若1L酸化后所得溶液中铬元素的总物质的量为0.55 mol,CrO42-有10/11转化为Cr2O72-。又知:常温时该反应的平衡常数K=1014。上述酸化后所得溶液的pH= ▲ 。
Cr2O72-+H2O,若1L酸化后所得溶液中铬元素的总物质的量为0.55 mol,CrO42-有10/11转化为Cr2O72-。又知:常温时该反应的平衡常数K=1014。上述酸化后所得溶液的pH= ▲ 。
(2)根据有关国家标准,含CrO42-的废水要经化学处理,使其浓度降至5.0×10-7 mol·L-1以下才能排放。含CrO42-的废水处理通常有以下两种方法。
①沉淀法:加入可溶性钡盐生成BaCrO4沉淀[Ksp(BaCrO4)=1.2×10-10],再加入可溶性硫酸盐处理多余的Ba2+。加入可溶性钡盐后的废水中Ba2+的浓度应不小于 ▲ mol·L-1,然后再进行后续处理方能达到国家排放标准。
②还原法:CrO42- Cr3+
Cr3+ Cr(OH)3。用该方法处理10 m3 CrO42-的物质的量浓度为1.0×10—3 mol·L-1的废水,至少需要绿矾(FeSO4·7H2O,相对分子质量为278) ▲ Kg(保留两位小数)。
Cr(OH)3。用该方法处理10 m3 CrO42-的物质的量浓度为1.0×10—3 mol·L-1的废水,至少需要绿矾(FeSO4·7H2O,相对分子质量为278) ▲ Kg(保留两位小数)。
以含有Al2O3、Fe2O3等杂质的铬铁矿[主要成份为Fe(CrO2)2]为主要原料生产重铬酸钠晶体( Na2Cr2O7·2H2O)的主要工艺流程如下:
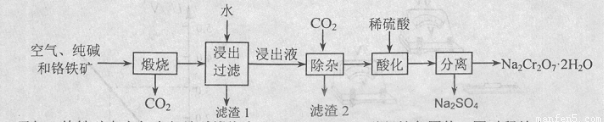
己知:铬铁矿在空气中与纯碱煅烧生成Na2CrO4和一种红棕色固体,同时释放出CO2气体,同时A12O3+Na2CO3  2NaAlO2+CO2↑。请回答:
2NaAlO2+CO2↑。请回答:
(1)在铬铁矿Fe(CrO2)2中,Cr的化合价为____。
(2)滤渣1的成分为________,滤渣2的成分为____。
(3)将滤渣l放入稀硫酸溶解后得溶液W,检验该溶液中金属离子的方法是??????? 。
(4)铬铁矿中的Al2O3杂质在工业上可用来冶炼铝,该化学方程式为
(5)根据有关国家标准,含CrO42-的废水要经化学处理,使其浓度降至5.0×10-7 mo1/L以下才能排放。含CrO42-的废水处理通常有以下两种方法。
①沉淀法:加入可溶性钡盐生成BaCrO4沉淀 ,再加入可溶性硫酸盐处理多余的Ba2+。加入可溶性钡盐后的废水中Ba2+的浓度应不小于?????????? mol/L,后续废水处理方能达到国家排放标准。
,再加入可溶性硫酸盐处理多余的Ba2+。加入可溶性钡盐后的废水中Ba2+的浓度应不小于?????????? mol/L,后续废水处理方能达到国家排放标准。
②还原法: 。写出酸性条件下 CrO42-与绿矾在溶液中反应的离子方程式?????????????????? 。
。写出酸性条件下 CrO42-与绿矾在溶液中反应的离子方程式?????????????????? 。
(6)某高效净水剂是由K2FeO4得到的,工业上以溶液W、次氯酸钾和氢氧化钾为原料制备K2FeO4,该反应的化学方程式是?????????????? 。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com