
题目列表(包括答案和解析)
(1)(19分)①研究性学习小组为了证明铁的金属性比铜强,他设计了如下几种方案,其中合理的是 (填序号)
| A.铁片置于硫酸铜溶液中有铜析出; |
| B.铁、铜与氯气反应分别生成FeCl3、CuCl2; |
| C.铜片置于FeCl3溶液中,铜片逐渐溶解(2FeCl3+Cu=2FeCl2+ CuCl2) |
| D.铁片、铜片分别置于盛有稀硫酸的烧杯中,铁片上有气泡产生,而铜片无气泡 |


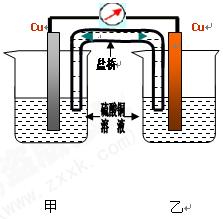
 及电极均相同,两杯溶液的温度不同,可否形成原电池
及电极均相同,两杯溶液的温度不同,可否形成原电池| 甲杯硫酸铜浓度 mol/L | 0.8 | 0.8 | 0.8 | 0.8 | 0.8 | 0.8 |
| 乙杯硫酸铜浓度 mol/L | 0.8 | 0.4 | 0.2 | 0.1 | 0.05 | 0.025 |
| 两杯溶液浓度差值 | 0 | 0.4 | 0.6 | 0.7 | 0.75 | 0.775 |
| 电压 mV | 0 | 6 | 12 | 16 | 22 | 26 |
电流 mA mA | 0 | 0.02 | 0.04 | 0.06 | 0.07 | 0.08 |
| 甲杯硫酸铜温度℃ | 19 | 19 | 19 | 19 | 19 | 19 |
| 乙杯硫酸铜温度℃ | 19 | 29 | 39 | 49 | 59 | 69 |
| 两杯溶液温差℃ | 0 | 10 | 20 | 30 | 40 | 50 |
| 电压 mV | 0 | 6.1 | 12 | 20 | 27 | 34 |
| 电流 mA | 0 | 0.025 | 0.047 | 0.07 | 0.15 | 0.18 |
 面有铜析出。
面有铜析出。
| A.铁片置于硫酸铜溶液中有铜析出; |
| B.铁、铜与氯气反应分别生成FeCl3、CuCl2; |
| C.铜片置于FeCl3溶液中,铜片逐渐溶解(2FeCl3+Cu=2FeCl2+ CuCl2) |
| D.铁片、铜片分别置于盛有稀硫酸的烧杯中,铁片上有气泡产生,而铜片无气泡 |
 及电极均相同,两杯溶液的温度不同,可否形成原电池
及电极均相同,两杯溶液的温度不同,可否形成原电池| 甲杯硫酸铜浓度 mol/L | 0.8 | 0.8 | 0.8 | 0.8 | 0.8 | 0.8 |
| 乙杯硫酸铜浓度 mol/L | 0.8 | 0.4 | 0.2 | 0.1 | 0.05 | 0.025 |
| 两杯溶液浓度差值 | 0 | 0.4 | 0.6 | 0.7 | 0.75 | 0.775 |
| 电压 mV | 0 | 6 | 12 | 16 | 22 | 26 |
电流 mA mA | 0 | 0.02 | 0.04 | 0.06 | 0.07 | 0.08 |
| 甲杯硫酸铜温度℃ | 19 | 19 | 19 | 19 | 19 | 19 |
| 乙杯硫酸铜温度℃ | 19 | 29 | 39 | 49 | 59 | 69 |
| 两杯溶液温差℃ | 0 | 10 | 20 | 30 | 40 | 50 |
| 电压 mV | 0 | 6.1 | 12 | 20 | 27 | 34 |
| 电流 mA | 0 | 0.025 | 0.047 | 0.07 | 0.15 | 0.18 |
 面有铜析出。
面有铜析出。
请从给出的3道化学题中任选一题做答
1.[化学——选修化学与技术]
请回答氯碱工业中的如下问题:
(1)氯气、烧碱是电解食盐水时按照固定的比率k(质量比)生成的产品。理论上k__________(要求计算表达式和结果);
(2)原料粗盐中常含有泥沙和Ca2+、Mg2+、Fe3+、 等杂质,必须精制后才能供电解使用。精制时,粗盐溶于水过滤后,还要加入的试剂分别为①Na2CO3、②HCl(盐酸)、③BaCl2,这3种试剂添加的合理顺序是_________(填序号);
等杂质,必须精制后才能供电解使用。精制时,粗盐溶于水过滤后,还要加入的试剂分别为①Na2CO3、②HCl(盐酸)、③BaCl2,这3种试剂添加的合理顺序是_________(填序号);
(3)氯碱工业是高耗能产业,一种将电解池与燃料电池相组合的新工艺可以节(电)能30%以上。在这种工艺设计中,相关物料的传输与转化关系如下图所示,其中的电极未标出,所用的离子膜都只允许阳离子通过。

①图中X、Y分别是_________、_________(填化学式),分析比较图示中氢氧化钠质量分数a%与b%的大小_________;
②分别写出燃料电池B中正极、负极上发生的电极反应
正极:_________;负极:_________;
③这样设计的主要节(电)能之处在于(写出2处)
___________________________、___________________________。
2.[化学——选修物质结构与性质]
已知X、Y和Z三种元素的原子序数之和等于42。X元素原子的4p轨道上有3个未成对电子,Y元素原子的最外层2p轨道上有2个未成对电子。X跟Y可形成化合物X2Y3,Z元素可以形成负一价离子。请回答下列问题:
(1)X元素原子基态时的电子排布式为_________,该元素的符号为_________;
(2)Y元素原子的价层电子的轨道表示式为_________,该元素的名称是_________;
(3)X与Z可形成化合物XZ3,该化合物的空间构型为________________________;
(4)已知化合物X2Y3在稀硫酸溶液中可被金属锌还原为XZ3,产物还有ZnSO4和H2O,该反应的化学方程式是____________________________________;
(5)比较X的氢化物与同族第二、三周期元素所形成的氢化物稳定性、沸点高低并说明理由____________________________________。
3.[化学——选修有机化学基础]
A~J均为有机化合物,它们之间的转化如下图所示:

实验表明:
①D既能发生银镜反应,又能与金属钠反应放出氢气;
②核磁共振氢谱表明F分子中有三种氢,且其峰面积之比为1∶1∶1;
③G能使溴的四氯化碳溶液褪色;
④1 mol J与足量金属钠反应可放出22.4 L氢气(标准状况)。
请根据以上信息回答下列问题:
(1)A的结构简式为_________(不考虑立体异构),由A生成B的反应类型是_________反应;
(2)D的结构简式为___________________________;
(3)由E生成F的化学方程式为____________,E中的官能团有____________(填名称),与E具有相同官能团的E的同分异构体还有____________(写出结构简式,不考虑立体异构);
(4)G的结构简式为____________________________________;
(5)由I生成J的化学方程式为________________________。
| 温度/℃ | 10 | 20 | 30 | 40 | 50 | 70 |
| (NH4)2SO4 | 73.0 | 75.4 | 78.0 | 81.0 | 84.5 | 91.9 |
| FeSO4?7H2O | 40.0 | 48.0 | 60.0 | 73.3 | - | - |
| (NH4)2Fe(SO4)2?6H2O | 18.1 | 21.2 | 24.5 | 27.9 | 31.3 | 38.5 |
| 1 |
| V |
| 1 |
| V |
2005年江苏酸雨污染有所加重,酸雨发生频率为34.1%,上升了6.2个百分点,每三场雨中就有一场多是酸雨。某校研究性学习小组拟对本市空气中二氧化硫含量(![]() )进行测定。经查阅资料可采用以下方法:
)进行测定。经查阅资料可采用以下方法:
实验原理:大气中的二氧化硫用甲醛溶液吸收后,生成稳定的羟甲基磺酸加成化合物,再加入氢氧化钠使加成化合物分解,释放出二氧化硫,与副玫瑰苯胺、甲醛作用,生成紫红色化合物。据其颜色深浅,用分光光度计在577nm处进行测定。
分光光度计是利用分光光度法对物质进行定量、定性分析的仪器。而分光光度法则是通过测定被测物质在特定波长时光的吸收度,对该物质进行定性和定量分析。其工作原理可以简单地用公式表示为![]() ,其中A为吸光度,K为一定条件下的常数,c为溶液浓度。
,其中A为吸光度,K为一定条件下的常数,c为溶液浓度。

实验步骤:
(1)采样:
①若你是该兴趣小组成员,你对采样的地点和时间有何建议:
②用图装置采样。通过50L空气后,将吸收液移入100mL容量瓶,用少量吸收液分两次洗涤吸收装置,合并洗涤液于容量瓶中,定容备用。用多孔球泡而不用导管的原因是
(2)吸光度与![]() 含量标准曲线的绘制:在6支25mL比色管中,用每毫升含25
含量标准曲线的绘制:在6支25mL比色管中,用每毫升含25![]() 二氧化硫的标准液配置下表中的标准
二氧化硫的标准液配置下表中的标准![]() 含量系列。
含量系列。
二氧化硫标准系列
| 管号 | 0 | 1 | 2 | 3 | 4 | b |
| 标准液/mL | 0 | 0.20 | 0.40 | 0.60 | 0.80 | 1.00 |
| 吸收液/mL | 10.00 | 9.80 | 9.60 | 9.40 | 9.20 | 9.00 |
| 二氧化硫含量/ | 0 | 5.00 | 10.00 | 15.00 | 20.00 | 25.00 |
用10mL比色皿,以水为参比,测定各管吸光度,实验结果如下。
| 管 号 | 0 | 1 | 2 | 3 | 4 | 5 |
| 吸光度 | 0 | 0.20 | 0.40 | 0.60 | 0.80 | 1.00 |
以吸光度值为纵坐标,二氧化硫含量(![]() )为横坐标,绘制标准曲线。
)为横坐标,绘制标准曲线。
(3)准确量取容量瓶中溶液10mL加人比色皿,测得其吸光度值为0.24,则空气中二氧化硫含量为 ![]() 。我国环境空气质量标准中对每次空气质量测定中
。我国环境空气质量标准中对每次空气质量测定中![]() 的最高浓度限值(m9/m3):一级标准:0.15,二级标准:0.50,三级标准:0.70。则该市空气为 级标准。
的最高浓度限值(m9/m3):一级标准:0.15,二级标准:0.50,三级标准:0.70。则该市空气为 级标准。
(4)甲、乙两组同学测定结果相差较大,试分析乙组同学测定空气中![]() 含量偏小的可能原因:(两个所用药品和装置均无问题)
含量偏小的可能原因:(两个所用药品和装置均无问题)
(5)请你提出江苏防治酸雨的两条主要措施:
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com