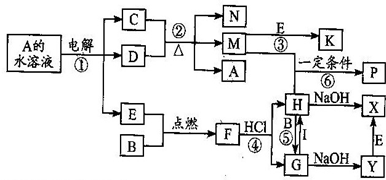
已知B、C为常见的两种金属单质,E、I为常见的两种非金属单质,A为硫酸盐反应②为D的溶液与C在加热条件下的反应,P溶液和G溶液中具有相同的阳离子,请根据要求回答下列问题.

(1)B元素在周期表的位置:
第四周期第ⅤⅢ族
第四周期第ⅤⅢ族
,
(2)物质I的电子式:
.
(3)Y转变为X的现象是:
白色絮状沉淀迅速变为灰绿色,最终转化为红褐色
白色絮状沉淀迅速变为灰绿色,最终转化为红褐色
.涉及的反应方程式为:
4Fe(OH)2+O2+2H2O=4Fe(OH)3
4Fe(OH)2+O2+2H2O=4Fe(OH)3
.
(4)写出反应④的化学反应方程式:
Fe3O4+8HCl=FeCl2+2FeCl3+4H2O
Fe3O4+8HCl=FeCl2+2FeCl3+4H2O
.物质F与HI水溶液的离子反应方程式 式:
Fe3O4+2I-+8H+=I2+3Fe2++4H2O
Fe3O4+2I-+8H+=I2+3Fe2++4H2O
.
(5)向沸水中加入H的饱和溶液,可得到红褐色溶液,其溶液所具有性质
AC
AC
.
A.具有丁达尔效应
B.处加直流电源阳极附近溶液颜色加深
C.加入盐酸溶液出现先沉淀后溶解的现象
D.能透过半透膜,不能透过滤纸
(6)向含1molG的溶液中加入1molNa
2O
2,所发生的离子反应方程式:
4Fe 2++4Na2O2+6H2O═4Fe(OH)3↓+8Na++O2↑
4Fe 2++4Na2O2+6H2O═4Fe(OH)3↓+8Na++O2↑
.