
题目列表(包括答案和解析)
 Ⅰ、电解原理在化学工业中有广泛应用.图表示一个电解池,装有电解液c;A、B是两块电极板,通过导线与直流电源相连.
Ⅰ、电解原理在化学工业中有广泛应用.图表示一个电解池,装有电解液c;A、B是两块电极板,通过导线与直流电源相连.某小组为研究电化学原理,设计如图装置。下列叙述不正确的是( )

A、a和b不连接时,铁片上会有金属铜析出
B、a和b用导线连接时,铜片上发生的反应为:Cu2++2e-= Cu
C、无论a和b是否连接,铁片均会溶解,溶液从蓝色逐渐变成浅绿色
D、a和b用导线连接时,可形成原电池,其中阳离子向负极移动
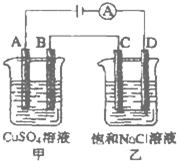 回答下列各题:
回答下列各题:
 Fe、Cu、Al是常见的金属元素,按要求回答下列问题:
Fe、Cu、Al是常见的金属元素,按要求回答下列问题:湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com