
题目列表(包括答案和解析)
(15分)(1)右图是![]() 和
和![]() 反应生成
反应生成![]() 和
和![]() 过程中能量变化示意,请写出
过程中能量变化示意,请写出![]() 和
和![]() 反应的热化学方程式_________________________________。
反应的热化学方程式_________________________________。
(2)已知下列热化学方程式:
![]()
![]() =-393.5 kJ?mol-1
=-393.5 kJ?mol-1
![]()
![]() =-483.6 kJ?mol-1
=-483.6 kJ?mol-1
![]()
![]() =-283.0 kJ?mol-1
=-283.0 kJ?mol-1
由此可知反应:![]() 9
9![]() 的焓变为_________。
的焓变为_________。
 (3)某温度时
(3)某温度时![]() 在水中的沉淀溶解平衡曲线如同所示。(提示
在水中的沉淀溶解平衡曲线如同所示。(提示![]() ⇋
⇋![]() (aq)的平衡秆数
(aq)的平衡秆数![]() ?
?![]() ,称为溶度积常数。)下列说法正确的是_____(填字母序号)。
,称为溶度积常数。)下列说法正确的是_____(填字母序号)。
A.加入![]() 可以使溶液由a点变到b点
可以使溶液由a点变到b点
B.通过蒸发可以使溶液由d点变到c点
C.d点无![]() 沉淀生成
沉淀生成
D.a点对应的![]() 等于c点对应的
等于c点对应的![]()
(4)在一固定体积的密闭容器中,进行如下化学反应:
![]()
![]() <0,其化学平衡常数K与t关系如下表:
<0,其化学平衡常数K与t关系如下表:
t/K | 298 | 398 | 498 | …… |
K/(mol?L | 4.1× | K | K | …… |
请完成下列问题:
①试比较K![]() 、K
、K![]() 的大小,K1_______K2(填写“>”“=”或“<”)
的大小,K1_______K2(填写“>”“=”或“<”)
②下列各项能作为判断浚反应达到化学平衡状态的依据的是__________(填字母序号)。
A.容器内![]() 、
、![]() 、
、![]() 的浓度之比为1:3:2 B.
的浓度之比为1:3:2 B. ![]()
C.容器内坼强保持不变 D.混合气体的密度保持不变
E.混合气体的平均相对分子质量不再改蛮 E.混合气体中各成分的浓度不再改变
(1)有一部分化学反应的反应热测定起来很困难,我们可以根据盖斯定律计算获得。如同素异形体之间的转化反应热数值小且转化慢,测定较困难。已知:
①4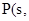 白磷
白磷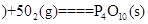 △H=-2983.2KJ/mol
△H=-2983.2KJ/mol
②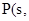 红磷
红磷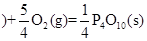 △H=-738.5KJ/mol
△H=-738.5KJ/mol
写出白磷转化为红磷的热化学方程式:__________________________。则对应下列化学反应过程中的能量变化图,能正确反映出由白磷转化为红磷的是_______。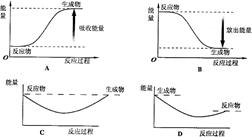
(2)(6分)有右图装置:回答下列问题: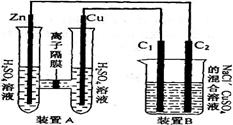
①装置A是_______池,B是_______池。
②装置A中的Zn极是_______极,Cu极上的电极反应方程式为:___。
③锌与铁组成的合金在潮湿的空气中,锌被腐蚀而另一种金属被保护,这种保护方法称为
(1)有一部分化学反应的反应热测定起来很困难,我们可以根据盖斯定律计算获得。如同素异形体之间的转化反应热数值小且转化慢,测定较困难。已知:
①4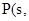 白磷
白磷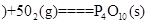 △H=-2983.2KJ/mol
△H=-2983.2KJ/mol
②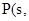 红磷
红磷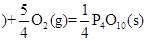 △H=-738.5KJ/mol
△H=-738.5KJ/mol
写出白磷转化为红磷的热化学方程式:__________________________。则对应下列化学反应过程中的能量变化图,能正确反映出由白磷转化为红磷的是_______。

(2)(6分)有右图装置:回答下列问题:
①装置A是_______池,B是_______池。
②装置A中的Zn极是_______极,Cu极上的电极反应方程式为:___。
③锌与铁组成的合金在潮湿的空气中,锌被腐蚀而另一种金属被保护,这种保护方法称为
不同物质的溶解度会随温度的变化而发生不同的变化,利用这一性质,我们可以将物质进行分离和提纯。工业上制取
硝酸钾就是利用了该原理。请你回答以下问题:
1.右图是几种盐的溶解度曲线,下列说法正确是
(A)40℃时,将35克食盐溶于100克水中,降温至0℃时,可析 出氯化钠晶体
(B)20℃时,硝酸钾饱和溶液的质量百分比浓度是31.6%
(C)60℃时,200克水中溶解80克硫酸铜达饱和.当降温至30℃时,可析出30克硫酸铜晶体
(D)30℃时,将35克硝酸钾和35克食盐同时溶于100克水中, 蒸发时,先析出的是氯化钠
2.从右图曲线中可以分析得到KNO3和NaCl的溶解度随温度变化的关系是 。
3.请填写空白。
步骤 | 操作 | 具体操作步骤 | 现象解释结论等 |
① |
溶解 | 取20克NaNO3和17克KCl溶解在35ml水中,加热至沸,并不断搅拌。 | NaNO3和KCl溶于水后产生四种离子,这四种离子可能组成四种物质 、 、 、 。这四种物质在不同温度下的溶解度特点 |
② | 蒸发 | 继续加热搅拌,使溶液蒸发浓缩。 | 有 晶体析出。 |
③ |
| 当溶液体积减少到约原来的一半时,迅速趁热过滤 | 滤液中的最主要成分为 。 |
④ | 冷却 | 将滤液冷却至室温。 | 有 晶体析出。尚有少量的 析出。 |
⑤ |
| 按有关要求进行操作 | 得到初产品硝酸钾晶体(称量为m1) |
⑥ |
| 将得到的初产品硝酸钾晶体溶于适量的水中,加热、搅拌,待全部溶解后停止加热,使溶液冷却至室温后抽滤。 |
得到纯度较高的硝酸钾晶体(称量为m2) |
⑦ |
检验 | 分别取⑤、⑥得到的产品,配置成溶液后分别加入1d1mol/l的HNO3和2d0.1mol/l的AgNO3 | 可观察到⑤、⑥产品中出现的现象分别是
|
(1)检验所得产品中是否Cl-的目的是 。结合⑤、⑥步实验得到的产品质量,计算初产品的纯度为 。(不考虑损失)
(2)步骤③过滤使用了保温漏斗,用图所示装置,其主要作用是

(3)步骤③过滤装置如图1―8所示,采用这种装置过滤的主要目的是 
这种装置工作的主要原理是
(4)玻璃棒在实验中一般有如下三种用途:搅拌、引流和蘸取溶液,上述实验步骤中一般需要用到玻璃棒的是_______________(填代号).
(6分)利用右图所示装置制备氧气并进行相关实验探究。
 (1)将3.9g过氧化钠放入烧瓶中,加入100mLH2O,用排水法收集气体,过氧化钠与水反应的化学方程式是 。
(1)将3.9g过氧化钠放入烧瓶中,加入100mLH2O,用排水法收集气体,过氧化钠与水反应的化学方程式是 。
(2)已知:酚酞在c(OH-) 为1.0×10-4mol/L~2.5mol/L时呈红色,且半分钟内不褪色;H2O2具有氧化性和漂白性,在MnO2催化条件下迅速分解。取上述实验得到的溶液于试管中,滴入2滴酚酞试液,溶液变红色,片刻红色褪去。(假设过程中液体体积不变)
①甲同学认为“红色迅速褪去”是由于溶液中c(OH-)过大造成的。请通过计算对比数据加以说明上述观点是否正确。 。
②乙同学认为“红色迅速褪去”是由于溶液中存在H2O2,其来源可能是Na2O2+2H2O=2NaOH+H2O2。试设计简单实验证明烧瓶内溶液中含H2O2,简述实验原理 。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com