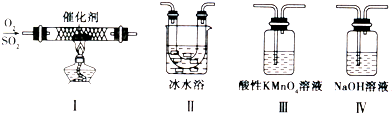
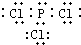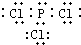(2011?德州二模)工业上采用的一种污水处理方法如下:保持污水的pH在5.0~6.0之间,通过电解生成Fe(OH)
3沉淀.Fe(OH)
3有吸附性,可吸附污物而沉积下来,具有净化水的作用.阴极产生的气泡把污水中悬浮物带到水面形成浮渣层,刮去(或撇掉)浮渣层,即起到了浮选净化的作用.某科研小组用该原理处理污水,设计装置示意图.如图所示.
(l)实验时若污水中离子浓度较小,导电能力较差,产生气泡速率缓慢,无法使悬浮物形成浮渣.此时应向污水中加入适重的
c
c
a.H
2SO
4 b.CH
3CH
2OH c.Na
2SO
4 d. NaOH e. BaSO
4(2)电解池阳极实际发生了两个电极反应,其中一个反应生成一种无色气体,则阳极的电极反应式分别是
I.
Fe-2e-=Fe2+
Fe-2e-=Fe2+
; II.
2H2O-4e-=4H++O2↑
2H2O-4e-=4H++O2↑
(3)该燃料电池是以熔融碳酸盐为电解质,CH
4为燃料,空气为氧化剂,稀土金属材料做电极.为了使该燃料电池长时间稳定运行,电池的电解质组成应保持稳定,电池工作时必须有部分A 物质参加循环(见图).A物质的化学式是
CO2
CO2
(4)已知燃料电池中有1.6g CH
4参加反应,则C电极理论上生成气体
8.96L
8.96L
L (标准状况).
(5)若将装置中的甲部分换为如图所示的装置,写出该电解过程中的化学方程式:
2CuSO
4+2H
20
2Cu+2H
2SO
4+O
2↑
2CuSO
4+2H
20
2Cu+2H
2SO
4+O
2↑
.

 (2011?德州二模)工业上采用的一种污水处理方法如下:保持污水的pH在5.0~6.0之间,通过电解生成Fe(OH)3沉淀.Fe(OH)3有吸附性,可吸附污物而沉积下来,具有净化水的作用.阴极产生的气泡把污水中悬浮物带到水面形成浮渣层,刮去(或撇掉)浮渣层,即起到了浮选净化的作用.某科研小组用该原理处理污水,设计装置示意图.如图所示.
(2011?德州二模)工业上采用的一种污水处理方法如下:保持污水的pH在5.0~6.0之间,通过电解生成Fe(OH)3沉淀.Fe(OH)3有吸附性,可吸附污物而沉积下来,具有净化水的作用.阴极产生的气泡把污水中悬浮物带到水面形成浮渣层,刮去(或撇掉)浮渣层,即起到了浮选净化的作用.某科研小组用该原理处理污水,设计装置示意图.如图所示.