
题目列表(包括答案和解析)
(共12分)配平下面的化学方程式(将有关的化学计量数填入答题卡的横线上):
(1)□KMnO4+□FeSO4+□H2SO4=□Fe2(SO4)3+□MnSO4+□K2SO4+□H2O
(2)□C2O42-+□MnO4-+□H+= □CO2+□Mn2++□H2O
(3) □Cu2S + □HNO3 =□Cu(NO3)2 +□ NO↑ + □H2SO4 + □H2O
(8分)工业甲醇的质量分数可以用下列方法测定:
①在稀H2SO4中甲醇被Cr2O72—氧化成CO2和H2O,反应式为:
CH3OH+Cr2O72—+8H+=CO2↑+2Cr3++6H2O;
②过量的Cr2O72—可用Fe2+与之完全反应:
_____Cr2O72—+_____Fe2++_____H+ —_____Cr3++______Fe3++______H2O
现有0.12 g工业甲醇,在H2SO4溶液中与25 mL 0.2 mol·L-1K2Cr2O7溶液反应,
多余的K2Cr2O7再用1 mol·L—1FeSO4与其反应,结果用去FeSO4溶液9.6 mL。
(1)配平第②步中离子方程式。
(2)计算工业甲醇的质量分数。
(8分)工业甲醇的质量分数可以用下列方法测定:
①在稀H2SO4中甲醇被Cr2O72—氧化成CO2和H2O,
反应式为:CH3OH+Cr2O72—+8H+=CO2↑+2Cr3++6H2O;
②过量的Cr2O72—可用Fe2+与之完全反应:
___Cr2O72—+___Fe2++____H+ —_____Cr3++____Fe3++____H2O
现有0.12 g工业甲醇,在H2SO4溶液中与25 mL 0.2 mol·L-1K2Cr2O7溶液反应,多余的K2Cr2O7再用1 mol·L—1FeSO4与其反应,结果用去FeSO4溶液9.6 mL。
(1)配平第②步的离子方程式___________________________
(2)计算工业甲醇的质量分数。
(12分)(1)5molCO2的质量是_________;在标准状况下所占的体积约为_________;所含的分子数目约为________________;所含氧原子的数目约为_________________。
(2)12.4gNa2X中含有0.4molNa+,则Na2X的摩尔质量是________,X的相对原子质量是________,该物质的化学式为________。
(3)有下列7种物质:Na2SO4、Na2SO3、K2SO4、I2、H2SO4、KIO3 、H2O组成一个氧化还原反应,请回答下列问题:
①将余下几种物质分别填入下面对应的横线上,组成一个未配平的化学方程式:
________+Na2SO3+________→ Na2SO4 +________+________+H2O
②反应物中发生氧化反应的物质是_________(填化学式),被还原的元素是_______。
(12分)(1)已知离子反应: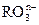 +6I—+6H+=R—+3I2+3H2O,n= ,R元素在
+6I—+6H+=R—+3I2+3H2O,n= ,R元素在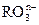 中的化合价是 。
中的化合价是 。
(2)化学实验中,如使某步中的有害产物作为另一步的反应物,形成一个循环,就可不再向环境排放该种有害物质。例如: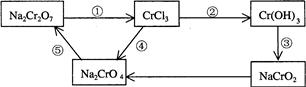
① 在上述有编号的步骤中,需用氧化剂的是 (填编号)。
②完成并配平下列反应的化学方程式,按要求标出电子转移的方向和数目,并回答问题:
__Na2Cr2O7+__KI+__HCl——__CrCl3+_NaCl+__KCl+__I2+ (用单线桥表示电子转移的方向、数目)
(用单线桥表示电子转移的方向、数目)
当反应中有3mol电子转移时,氧化产物的质量是 。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com