
题目列表(包括答案和解析)
(10分)为了验证木炭可被浓H2SO4氧化成CO2,选用下图所示仪器(内含物质)组装成实验装置:
(1)如按气流由左向右流向,连接上述装置的正确顺序是(填各接口字母):
接 , 接 , 接 ;
(2)仪器乙、丙应有怎样的实验现象才表明已检验出CO2?
乙中 ____ ,丙中 ______ ;
(3)丁中足量的酸性KMnO4溶液的作用是 ;
(4)写出甲装置中反应的化学方程式 。
![]()

21.(10分)工业上以硫铁矿为原料制硫酸所产生的尾气除了含有N2、O2外,还含有SO2、微量的SO3和酸雾。为了保护环境,同时提高硫酸工业的综合经济效益,应尽可能将尾气中的SO2转化为有用的副产品。请按要求回答下列问题:
(1)将尾气通入氨水中,能发生多个反应,写出其中可能发生的两个氧化还原反应的化学方程式:______ 。
(2)在尾气与氨水反应所得到的高浓度溶液中,按一定比例加入氨水或碳酸氢铵,此时溶液的温度会自行降低,并析出晶体。
①导致溶液温度降低的原因可能是________ ;
②析出的晶体可用于造纸工业,也可用于照相用显影液的生产。已知该结晶水合物的相对分子质量为134,则其化学式为 _______ ;
③生产中往往需要向溶液中加入适量的对苯二酚或对苯二胺等物质,其目的是_______ 。
(3)能用于测定硫酸尾气中SO2含量的是_____ 。(填字母)
A.NaOH溶液、酚酞试液 B.KMnO4溶液、稀H2SO4
C.碘水、淀粉溶液 D.氨水、酚酞试液
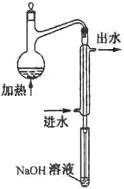
(08年江苏卷)(10分)金矿开采、冶炼和电镀工业会产生大量含氰化合物的污水,其中含氰化合物以HCN、CN -和金属离子的配离子M(CN)nm-的形式存在于水中。测定污水中含氰化合物含量的实验步骤如下:
①水样预处理:水样中加入磷酸和EDTA,在pH<2的条件下加热蒸馏,蒸出所有的HCN,并用NaOH溶液吸收。
②滴定:将吸收液调节至pH>11,以试银灵作指示剂,用AgNO3标准溶液滴定
 Ag++2CN - == [Ag(CN)2] -
Ag++2CN - == [Ag(CN)2] -
终点时,溶液由黄色变成橙红色。
根据以上知识回答下列问题:
⑴水样预处理的目的是 。
⑵水样预处理的装置如右图,细导管插入吸收液中是为了 ____
⑶蒸馏瓶比吸收液面要高出很多,其目的是 。
⑷如果用盐酸代替磷酸进行预处理,实验结果将 (填“偏高”、“无影响”或“偏低”)。
⑸准确移取某工厂污水100mL,经处理后用浓度为0.01000mol?L-1的硝酸银标准溶液滴定,终点时消耗了21.00mL。此水样中含氰化合物的含量为 mg?L-1的(以计,计算结果保留一位小数)。
(10分)金矿开采、冶炼和电镀工业会产生大量含氰化合物的污水,其中含氰化合物以HCN、CN -和金属离子的配离子M(CN)nm-的形式存在于水中。测定污水中含氰化合物含量的实验步骤如下:
①水样预处理:水样中加入磷酸和EDTA,在pH<2的条件下加热蒸馏,蒸出所有的HCN,并用NaOH溶液吸收。
②滴定:将吸收液调节至pH>11,以试银灵作指示剂,用AgNO3标准溶液滴定
Ag++2CN - ="=" [Ag(CN)2] -
终点时,溶液由黄色变成橙红色。
根据以上知识回答下列问题:
(1)水样预处理的目的是 。
(2)水样预处理的装置如右图,细导管插入吸收液中是为了 。
(3)蒸馏瓶比吸收液面要高出很多,其目的是 。
(4)如果用盐酸代替磷酸进行预处理,实验结果将 (填“偏高”、“无影响”或“偏低”)。
(5)准确移取某工厂污水100mL,经处理后用浓度为0.01000mol·L-1的硝酸银标准溶液滴定,终点时消耗了21.00mL。此水样中含氰化合物的含量为 mg·L-1(以CN-计,计算结果保留一位小数)。
| ||
| ||
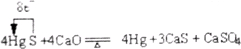
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com