
题目列表(包括答案和解析)
A经①、②两步反应得C、D和E。B经①、②两步反应得E、F和H。上述反应过程、产物性质及相互关系如图所示。


(1)写出E的结构简式 。
(2)A有2种可能的结构,写出相应的结构简式
。
(3)F和小粒金属钠反应的化学方程式是 ,
实验现象是 ,反应类型是 。
(4)写出F在浓H2SO4作用下在170℃发生反应的化学方程式:
,
实验现象是 ,反应类型是 。
(5)写出F与H在加热和浓H2SO4催化作用下发生反应的化学方程式
,
实验现象是 ,反应类型是 。
(6)在B、C、D、F、G、I化合物中,互为同系物的是 。
合成氨的发明是本世纪科学领域中最辉煌的成就之一。以下是与NH3相关的工业过程示意图。

已知:CH4(g) + 2O2(g) ==CO2(g)+2H2O(g)
△H = — 890kJ/mol
2CO(g) + O2(g) == 2CO2(g)
△H = — 566.0 kJ/mol
2H2(g) + O2(g) ==2H2O(g)
△H = — 571.6 kJ/mol
(1)请写出CH4(g)与O2(g)反应生成CO(g) 和H2(g)的热化学反应方程式:
_ 。
(2)生产中涉及H2和CO2的分离。你认为可取
的方法是(填代号) 。
A.在加压条件下用水吸收CO2
B.用NaOH溶液吸收CO2
C.加压,使CO2液化
(3)直接供氨式燃料电池在碱性条件下的负极反应为: 。
(4)合成尿素的反应分两步进行:
①CO2(g)+ 2NH3(g)![]() H2NCOONH4(aq)△H = — 159.47kJ/mol
H2NCOONH4(aq)△H = — 159.47kJ/mol
(氨基甲酸铵)
②H2NCOONH4(aq)![]() CO(NH2)2(aq)+ H2O(l)△H = + 28.49kJ/mol
CO(NH2)2(aq)+ H2O(l)△H = + 28.49kJ/mol
 在生产条件下,单位时间内获得尿素的产
在生产条件下,单位时间内获得尿素的产
量与压强和n(NH3):n(CO2)的关系如右图
所示。生产过程中n(NH3):n(CO2)的最佳
配比为 ,而实际生产往往使
n(NH3):n(CO2)≥3,这是因为
_ 。
在得到的尿素溶液中会含有少量的氨
基甲酸铵,除去这种杂质最简便的方法是 。
(5)将氨分为两部分,一部分经逐级氧化吸收转化为硝酸,另一部分又与HNO3反应生成NH4NO3。若HNO3与NH3的反应是完全的,有标准状况下78.4LNH3经上述反应过程生成120g NH4NO3。则NH3转化为HNO3的转化率为 _ 。
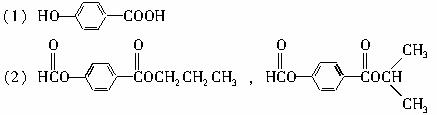 。A经①②两步反应得C、D和E。B经①②两步反应得E、F和H。上述反应过程、产物性质及相互关系如图所示。?
。A经①②两步反应得C、D和E。B经①②两步反应得E、F和H。上述反应过程、产物性质及相互关系如图所示。?  ?
?
(提示: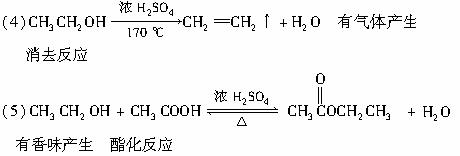
(1)写出E的结构简式? ? 。?
(2)A有2种可能的结构,写出相应的结构简式 。
(3)F和小粒金属钠反应的化学方程式是 ,实验现象是? ?,反应类型是? ?。?
(4)写出F在浓H2SO4作用下在170 ℃时发生反应的化学方程式: 。实验现象是? ?,反应类型是? ?。?
(5)写出F与H在加热和浓H2SO4催化作用下发生反应的化学方程式? ?。实验现象是? ?,反应类型是? ?。?
(6)在B、C、D、F、G、I化合物中,互为同系物的是? ?。
?
(每空3分共计10分)硫酸工业中废渣称为硫酸渣,其成分为SiO2、Fe2O3、Al2O3、MgO。某探究性学习小组的同学设计以下方案,进行硫酸渣中金属元素的提取实验。
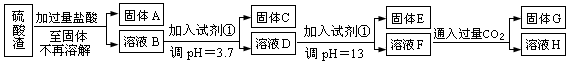
已知溶液pH=3.7时,Fe3+已经沉淀完全;一水合氨电离常数Kb=1.8×10-5,其饱和溶液中c(OH-)约为1×10-3mol·L-1。请回答:
(1)写出A与氢氧化钠溶液反应的化学方程式: 。
(2)上述流程中两次使用试剂①,推测试剂①应该是 (填以下字母编号)
A.氢氧化钠 B.氧化铝 C.氨水 D.水
(3)溶液D到固体E过程中需要控制溶液pH=13,如果pH过小,可能导致的后果是 ;(任写一点)
(4)H中溶质的化学式: ;
(5)计算溶液F中c(Mg2+)= (25℃时,氢氧化镁的Ksp=5.6×10-12)
(6分)(1)氨气催化氧化生产硝酸,硝酸厂常用催化还原法处理尾气:催化剂存在时用H2将NO2还原为N2。
已知:2H2(g)+O2(g)= 2H2O(g) ΔH="-483.6" kJ·mol-1
N2(g)+2O2(g)= 2NO2(g) ΔH="+67.7" kJ·mol-1
则H2还原NO2生成水蒸气反应的热化学方程式是 。
(2)氮气和氢气合成氨是化学工业中极为重要的反应,其热化学方程式可表示为:N2(g)+3H2(g) 2NH3(g) ΔH="-92" kJ·mol-1。请回答下列问题:
2NH3(g) ΔH="-92" kJ·mol-1。请回答下列问题:
①取1 mol N2(g)和3 mol H2(g)放在一密闭容器中,在催化剂存在时进行反应,测得反应放出的热量 92 kJ(填“大于”“等于”或“小于”),原因是 ;
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com