
题目列表(包括答案和解析)
(本题共12分)六水合高氯酸铜 [Cu(C1O4)2 ·6H2O]是一种蓝色晶体,易溶于水,120℃时开始分解。实验室用硫酸铜的粗产品制备少量高氯酸铜晶体的流程如下:

已知:
|
离子 |
溶液pH值 |
|
|
开始沉淀 |
沉淀完全 |
|
|
Fe2+ |
7.6 |
9.6 |
|
Fe3+ |
2.7 |
3.7 |
|
Cu2+ |
5.2 |
6.4 |
(1).写出A→B过程中发生反应的离子方程式为 。
(2).溶液C中加入稀硫酸调至pH=1的目的是________________________________________。
(3).如欲检验溶液C中的杂质是否除净,其操作是 。
(4).蒸发至__________(填写现象),然后经过冷却结晶、过滤、洗涤、 (填写操作),得到纯净的蓝色晶体。
(5).为了测定硫酸铜的粗产品的纯度,某同学称量硫酸铜的粗产品2.000g、 、 、(填写实验步骤)过滤、洗涤沉淀、在空气中灼烧,至质量不再改变时,称得质量为0.58816 g。
(6).该样品的纯度为___________。如果样品的实际纯度为93.2%,则测定的相对误差为__________。
(本题共12分)
以海水中常见物质A为原料可以发展很多种工业,下图中包含了中学课本中介绍的几种基本工业生产,请根据物质之间的转化关系回答下列问题:
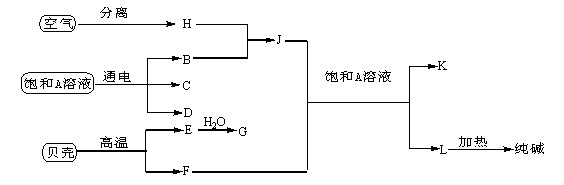
(1)C和D、C和G反应都可以制取消毒剂。C和G反应制取的消毒剂中有效成分的化学式为 ;
(2)写出电解A溶液的化学方程式为 ;
(3)若使工业合成J反应的平衡向生成J的方向移动,可采取的措施有 (填字母代号);
A.升高温度 B.增大压强 C.使用催化剂 D.液化分离
(4)将F和J通入A的饱合溶液中的顺序为 。
A.先通入F后通入J B.先通入J后通入F
C.同时通入 D.没有先后顺序要求
(5)图中所示工业制法获得的纯碱中常含有NaCl杂质,用下述方法可以测定样品中
NaCl的质量分数。
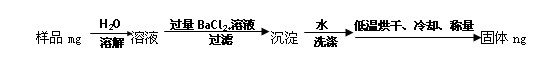 ①检验沉淀是否洗涤干净的所用到的试剂是:
,
①检验沉淀是否洗涤干净的所用到的试剂是:
,
②样品中NaCl的质量分数的数学表达式为: 。
(本题共12分)下表四组物质中,每组均有4个备选项,其中有1个选项与另外3个选项属于不同的分类,请把该选项的序号挑选出来,并说明你的挑选依据,分别填入下表相应空格内。
|
组别 |
备选项 |
不同分类选项 |
挑选依据 |
|
(1) |
A.CO B.CO2 C.SO2 D.P2O5 |
|
|
|
(2) |
A. 食盐水 B.浑浊的河水 C. 带有飘尘的空气 D. 二氧化碳气体 |
|
|
|
(3) |
A. CaO B.SO2 C. Na2O D. CuO |
|
|
|
(4) |
A. H2SO4 B. H2CO3 C. NaH2PO4 D. HNO3 |
|
|
(本题共12分)迷迭香酸(F)的结构简式为: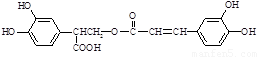 ;它是存在于许多植物中的一种多酚,具有抗氧化、延缓衰老、减肥降脂等功效,以A为原料合成F的路线如下:
;它是存在于许多植物中的一种多酚,具有抗氧化、延缓衰老、减肥降脂等功效,以A为原料合成F的路线如下:
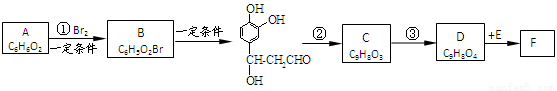
根据题意回答下列问题:
1.写出结构简式:A____________;D___________________。
2.写出反应类型:反应①________;反应②______________。
3.反应③的试剂:____________________________________。
4. 1 mol F分别与足量的溴水和NaOH溶液反应,最多可消耗Br2_____mol,NaOH____mol。
5.E在一定条件下发生缩聚反应的化学方程式是(已知苯环上羟基很难直接与羧酸发生酯化反应)______________________________________________________________。
6.与E互为同分异构体,且同时满足下列条件的有机物有_____________种。
①苯环上有四个取代基,且苯环上的一氯取代物只有一种。
②1 mol该物质分别与NaHCO3、Na2CO3反应时,最多消耗NaHCO3、Na2CO3的量分别是1 mol和4 mol。
(本题共12分)某无色透明溶液可能含有下列离子:K+、Al3+、Fe3+、Ba2+、NO3-、SO42-、HCO3-、Cl-,取该溶液进行如下实验:
①用蓝色石蕊试纸检测该溶液,试纸显红色;
②取溶液少许,加入铜片和稀盐酸共热,产生无色气体,该气体遇到空气立即变为红棕色;
③取溶液少许,加入氨水有白色沉淀生成,继续加入过量氨水,沉淀不消失;
④取溶液少许,滴入氯化钡溶液产生白色沉淀;
⑤取实验④后的澄清溶液,滴入硝酸银溶液产生白色沉淀,再加入过量的稀硝酸,沉淀不消失。
请回答下列问题:
(1)在实验①中,下图所示的操作中正确的是________(填代号)
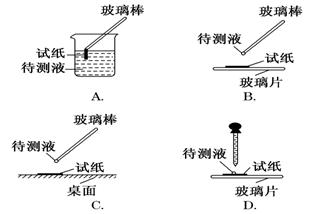
(2)根据上述实验判断原溶液中肯定存在的离子是________,肯定不存在的离子是________。
(3)写出与②③两个实验有关的离子方程式:
②________________________________;③_____________________________________
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com