
题目列表(包括答案和解析)
(14分)(1)Na2SO3溶液蒸干得到的固体物质是___________,原因是______________.
(2)碳酸氢钡溶液蒸干得到的固体物质是___________,原因是___________________.
(3)盐酸与硫酸浓度各为1mol/L 的混合酸10mL,加热浓缩至1mL,最后得到的溶液浓度
为_________,原因是_____________________________________________________。
(4)与c(H+)·c(OH-)=kw类似,FeS饱和溶液中存在:FeS(s)  Fe
Fe
 +S
+S
 ,
,
c(Fe )·c(s
)·c(s )=ksp。常温下ksp=8.1×10-17。(溶液密度为1.0g/cm3)。
)=ksp。常温下ksp=8.1×10-17。(溶液密度为1.0g/cm3)。
理论上FeS的溶解度为___________________。
(14分)
1.具有支链的化合物A的分子式为C4H6O2,A可以使溴的四氯化碳溶液退色。1 mol A和1 mol NaHCO3能完全反应,则A的结构简是 。
写出与A具有相同官能团的A的所有同分异构体的结构简式 、
。
2.化合物B含有C、H、O三种元素,相对分子质量为60,其中碳的质量分数为60%,氢的质量分数为13.3%。B在Cu的催化作用下被氧气氧化成C,C能发生银镜反应,则B的结构简式是 。物质B的核磁共振氢谱(NMR)会产生 个吸收峰,峰值比例为 。
3.D是由A和B反应生成的酯,相应反应的化学方程式是________________________
(14分)
1.具有支链的化合物A的分子式为C4H6O2,A可以使溴的四氯化碳溶液退色。1 mol A和1 mol NaHCO3能完全反应,则A的结构简是 。
写出与A具有相同官能团的A的所有同分异构体的结构简式 、
。
2.化合物B含有C、H、O三种元素,相对分子质量为60,其中碳的质量分数为60%,氢的质量分数为13.3%。B在Cu的催化作用下被氧气氧化成C,C能发生银镜反应,则B的结构简式是 。物质B的核磁共振氢谱(NMR)会产生 个吸收峰,峰值比例为 。
3.D是由A和B反应生成的酯,相应反应的化学方程式是________________________
(14分) (1)化学平衡常数K表示可逆反应的进行程度,K值越大,表示________________,K值大小与温度的关系是:温度升高,K值__________(填一定增大、一定减小、或可能增大也可能减小)。
(2)已知反应Cl2+H2O HCl+HClO,写出该反应化学平衡常数的表达式
HCl+HClO,写出该反应化学平衡常数的表达式
(3)在一体积为10L的容器中,通人一定量的CO和H2O,在850℃时发生如下反应:
CO(g)+H2O(g) CO2(g)+H2 (g) ΔH=-QkJ/mol (Q>0)
CO2(g)+H2 (g) ΔH=-QkJ/mol (Q>0)
CO和H2O浓度变化如下图,则0~4 min的平均反应速率v(CO)=______ mol/(L·min)
(4)t1℃(高于850℃)时,在相同容器中发生上述反应,容器内各物质的浓度变化如上表。
①表中3 min~4 min之间反应处于_________状态;C1数值_________0.08 mol/L (填大于、小于或等于)。
②反应在4 min~5 min问,平衡向逆方向移动,可能的原因是_______,表中5 min~6 min之间数值发生变化,可能的原因是_______。
a.增加水蒸气 b.降低温度 c.使用催化剂 d.增加氢气浓度
(14分) (1)化学平衡常数K表示可逆反应的进行程度,K值越大,表示________________,K值大小与温度的关系是:温度升高,K值__________(填一定增大、一定减小、或可能增大也可能减小)。
(2)已知反应Cl2+H2O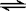 HCl+HClO,写出该反应化学平衡常数的表达式
HCl+HClO,写出该反应化学平衡常数的表达式
(3)在一体积为10L的容器中,通人一定量的CO和H2O,在850℃时发生如下反应:
CO(g)+H2O(g)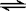 CO2(g)+H2
(g) ΔH=-QkJ/mol (Q>0)
CO2(g)+H2
(g) ΔH=-QkJ/mol (Q>0)
CO和H2O浓度变化如下图,则0~4 min的平均反应速率v(CO)=______ mol/(L·min)
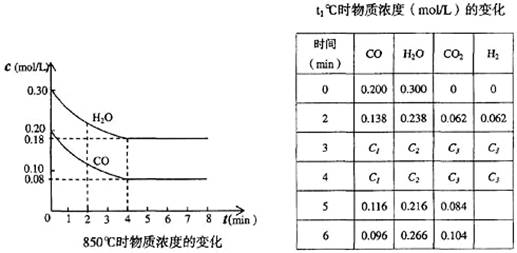
(4)t1℃(高于850℃)时,在相同容器中发生上述反应,容器内各物质的浓度变化如上表。
①表中3 min~4 min之间反应处于_________状态;C1数值_________0.08 mol/L (填大于、小于或等于)。
②反应在4 min~5 min问,平衡向逆方向移动,可能的原因是_______,表中5 min~6 min之间数值发生变化,可能的原因是_______。
a.增加水蒸气 b.降低温度 c.使用催化剂 d.增加氢气浓度
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com