
题目列表(包括答案和解析)
(10分)某课外活动小组进行Fe(OH)3胶体的制备实验并检验其性质。
(1)若将饱和FeCl3溶液分别滴入下列液体中,能形成胶体的是________。
A.冷水 B.沸水 C.NaOH浓溶液 D.NaCl浓溶液
(2)现有甲、乙、丙、丁四名同学进行Fe(OH)3胶体的制备
① 甲同学的操作是:取一小烧杯,加入25 mL蒸馏水加热至沸腾,向沸水中逐滴加入1~2 mL FeCl3饱和溶液,用玻璃棒搅拌,继续煮沸至溶液呈红褐色,停止加热。请评价该操作是否正确______________。
② 乙向沸水中滴加饱和FeCl3溶液,为了使反应进行充分,煮沸10分钟,请评价是否正确____________。
(3)写出制备Fe(OH)3胶体的化学方程式:__________________________。
(4)怎样检验制备的物质是否为胶体?____________________________。
(5)取少量你制得的胶体加入试管中,加入(NH4)2SO4溶液,现象是______________,这种现象称为胶体的____________。
(6)氢氧化铁胶体稳定存在的主要原因是__________。
A.胶粒直径小于1 nm B.胶粒带正电荷
C.胶粒作布朗运动 D.胶粒能透过滤纸
(10分)某校化学实验兴趣小组为了探究在实验室制备Cl2的过程中有水蒸气和HCl挥发出来,同时证明氯气的某些性质,甲同学设计了如图所示的实验装置(支撑用的铁架台省略),按要求回答问题.
(1)若用含有0.2 mol HCl的浓盐酸与足量的MnO2反应制Cl2,制得的Cl2体积(标准状况下)总是小于1.12 L的原因是___________________________________________.
(2)①装置B中盛放的试剂名称为____ ____,作用是____________________________,
现象是____________________________________________________________.
②装置D和E中出现的不同现象说明的问题是_________________________________
③装置F的作用是________________________________________________________.
④写出装置G中发生反应的离子方程式______________________________________
(3)乙同学认为甲同学的实验有缺陷,不能确保最终通入AgNO3溶液中的气体只有一种.为了确保实验结论的可靠性,证明最终通入AgNO3溶液的气体只有一种,乙同学提出在某两个装置之间再加一个装置.你认为该装置应加在________与________之间(填装置字母序号),装置中应放入________(填写试剂或用品名称).
(10分) 某温度(t℃)时,测得0.01 mol/L的NaOH溶液的pH为11,则该温度下水的Kw=________,该温度________25℃(填“大于”“小于”或“等于”),其理由是________________________________________________________________________
________________________________________________________________________.
此温度下,将pH=a的NaOH溶液Va L与pH=b的H2SO4溶液Vb L混合,通过计算填写以下不同情况时两溶液的体积比:
(1) 若所得溶液为中性,且a=12,b=2,则Va∶Vb=____________;
(2) 若所得溶液为中性,且a+b=12,则Va∶Vb=________;
(3) 若所得溶液的pH=10,且a=12,b=2,则Va∶Vb=______________.
(10分) 某温度(t℃)时,测得0.01 mol/L的NaOH溶液的pH为11,则该温度下水的Kw=________,该温度________25℃(填“大于”“小于”或“等于”),其理由是________________________________________________________________________
________________________________________________________________________.
此温度下,将pH=a的NaOH溶液Va L与pH=b的H2SO4溶液Vb L混合,通过计算填写以下不同情况时两溶液的体积比:
(1) 若所得溶液为中性,且a=12,b=2,则Va∶Vb=____________;
(2) 若所得溶液为中性,且a+b=12,则Va∶Vb=________;
(3) 若所得溶液的pH=10,且a=12,b=2,则Va∶Vb=______________.
(10分) 某研究性学习小组对过量炭粉与氧化铁(Fe2O3)反应的气体产物成分进行研究。
(1)提出假设
①气体产物是CO2。 ②气体产物是CO。 ③气体产物是 。
(2)设计方案
如图所示,将一定量的氧化铁在隔绝空气的条件下与过量炭粉完全反应,测定参加反应的碳元素与氧元素的质量比。
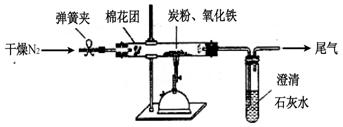
(3)查阅资料
氮气不与碳、氧化铁发生反应。实验室可以用氯化铵饱和溶液和亚硝酸钠(NaNO2)饱和溶液混合加热反应制得氮气,该反应的离子方程式: 。
(4)实验步骤
①按上图连接装置,并检查装置的气密性,称取3.20g氧化铁、0.48g碳粉混合均匀,放入50.00g的硬质玻璃管中;
②加热前,先通一段时间纯净干燥的氮气;
③停止通入N2后,夹紧弹簧夹,加热一段时间,澄清石灰水(足量)变浑浊;
④待反应结束,再缓缓通入一段时间的氮气。冷却至室温,称得硬质玻璃管和固体总质量为52.24g;
⑤过滤出石灰水中的沉淀,洗涤、烘干后称得质量为2.00g。
步骤②、④中都分别通入N2,其作用分别为 。
(5)数据处理
试根据实验数据分析判断,前面的假设_________(填①、②、③)是正确的。写出该实验中氧化铁与碳发生反应的化学方程式: 。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com