
题目列表(包括答案和解析)
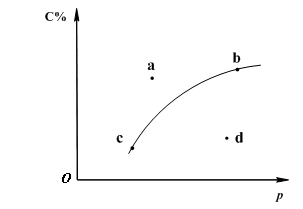
对于可逆反应2A(?)+B(g)![]() 2C(g);下图是其它条件一定时反应中C的百分含量与压强的关系曲线。回答下列问题:
2C(g);下图是其它条件一定时反应中C的百分含量与压强的关系曲线。回答下列问题:
(1)物质A的状态是 (填“气体”、“液体”或“固体”);
(2)图-1中a、b、c、d四点中表示未达到平衡状态且v正<v逆 的点是 ;
(3)在a、b、c三种条件下达平衡时,v(a)、v(b)、v(c)按由大到小排序___________;
 |
|
(4)对于2SO2(g)+O2(g)![]() 2SO3(g);ΔH=-198 kJ/mol。在实际生产过程中,原料气中SO2为7%(体积分数)、O2为11%,常压下进行,控制温度在450℃左右。
2SO3(g);ΔH=-198 kJ/mol。在实际生产过程中,原料气中SO2为7%(体积分数)、O2为11%,常压下进行,控制温度在450℃左右。
请问原料气中SO2与O2的体积比不是2∶1,而要7∶11(大约2∶3)的原因是
;如果在恒容容器中,仅把另外82%的其他气体“抽出来”,是否会减小SO2的转化率 (填“会”或“不会”)。
| c2(CO) |
| c(CO2) |
| c2(CO) |
| c(CO2) |
| tmin | Xmol | Ymol | Zmol |
| 0 | 1.00 | 1.00 | 0.00 |
| 1 | 0.90 | 0.80 | 0.20 |
| 3 | 0.75 | 0.50 | 0.50 |
| 5 | 0.65 | 0.30 | 0.70 |
| 9 | 0.55 | 0.10 | 0.90 |
| 10 | 0.55 | 0.10 | 0.90 |
| 14 | 0.55 | 0.10 | 0.90 |
 2Z
2Z 2Z
2Z
(7分)对于反应2SO2+O2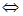 2SO3(g),当其他条件不变时,只改变一个反应条件,将生成的SO3的反应速率的变化填入下表空格内(填“增大”“减小”或“不变”)。
2SO3(g),当其他条件不变时,只改变一个反应条件,将生成的SO3的反应速率的变化填入下表空格内(填“增大”“减小”或“不变”)。
| 编号 | 改变的条件 | 生成SO3的速率 |
| ① | 升高温度 | |
| ② | 降低温度 | |
| ③ | 增大氧气的浓度 | |
| ④ | 使用催化剂 | |
| ⑤ | 压缩体积 | |
| ⑥ | 恒容下充入Ne | |
| ⑦ | 恒压下充入Ne | |
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com