
题目列表(包括答案和解析)
(共14分)
Ⅰ.(2分)下列有关仪器的使用,能实现的是_______________(填序号)
A.用托盘天平称取11.70g食盐
B.用量筒量取12.36mL盐酸
C.用酸式滴定管量取21.20mL 0.10mol/L H2SO4溶液
D.用200mL容量瓶配制500mL 0.1mol/L NaCl溶液
Ⅱ.(6分)现用物质的量浓度为a mol/L的标准盐酸去测定V mL NaOH溶液的物质的量浓度,请填写下列空白:
(1)酸式滴定管用蒸馏水洗净后,还应该进行的操作是_______________________。
(2)下图是酸式滴定管中液面在滴定前后的读数:

C (NaOH) = _________________。
(3)若在滴定前滴定管尖嘴部分留有气泡,滴定后滴定管尖嘴部分气泡消失,则测定的NaOH物质的量浓度会偏_________________。
III. (6分)我们知道空气中含有N2、O2、CO2、H2S等气体。试判断下列滴定操作的终点、分析下列现象的原因,并写出有关离子方程式。
(1)以酚酞为指示剂,用碱液滴定酸液到 为终点。约半分钟后导致褪色的原因: 。
(2)以淀粉为指示剂,用Na2S2O3滴定I2(2S2O32-+I2=S4O62-+2I-)到 为终点,约5min后溶液又显色的原因: 。
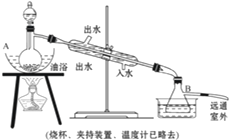 乙酸乙酯是无色具有水果香味的液体,沸点77.2℃,某同学制取它用冰醋酸14.3mL,95%的乙醇 23mL,还用到浓硫酸、饱和碳酸钠以及极易与乙醇结合成六水合物的氯化钙溶液.主要仪器如图所示.
乙酸乙酯是无色具有水果香味的液体,沸点77.2℃,某同学制取它用冰醋酸14.3mL,95%的乙醇 23mL,还用到浓硫酸、饱和碳酸钠以及极易与乙醇结合成六水合物的氯化钙溶液.主要仪器如图所示.(14分) “洁净煤技术”研究在世界上相当普遍,科研人员通过向地下煤层气化炉中交替鼓入空气和水蒸气的方法,连续产出了热值高达122500~16000 kJ·m-3的煤炭气,其主要成分是CO和H2。CO和H2可作为能源和化工原料,应用十分广泛。
(1)已知:
C(s)+O2(g)=CO2(g) ΔH1=—393.5 kJ·mol-1 ①
2H2(g)+O2(g)=2H2O(g) ΔH2=—483.6 kJ·mol-1 ②
C(s)+H2O(g)=CO(g)+H2(g) ΔH3=+131.3 kJ·mol-1 ③
则反应CO(g)+H2(g) +O2(g)=H2O(g)+CO2(g),ΔH= kJ·mol-1。标准状况下的煤炭气(CO、H2)33.6 L与氧气完全反应生成CO2和H2O,反应过程中转移 mol e-。
(2)工作温度650℃的熔融盐燃料电池,是用煤炭气(CO、H2)作负极燃气,空气与CO2的混合气体在正极反应,用一定比例的Li2CO3和Na2CO3低熔点混合物做电解质,以金属镍(燃料极)为催化剂制成的。负极的电极反应式为:CO+H2-4e-+2CO32-=3CO2+H2O;则该电池的正极反应式为 。
(3)密闭容器中充有10mol CO与20 mol H2,在催化剂作用下反应生成甲醇:CO(g)+2H2(g) CH3OH(g);CO的平衡转化率(α)与温度、压强的关系如右图所示。
①若A、B两点表示在某时刻达到的平衡状态,此时在A点时容器的体积为VAL,则该温度下的平衡常数K= ;A、B两点时容器中物质的物质的量之比为n(A)总:n(B)总= 。
②若A、C两点都表示达到的平衡状态,则自反应开始到达平衡状态所需的时间tA tC(填“大于”、“小于”或“等于”)。
③在不改变反应物用量的情况下,为提高CO的转化率可采取的措施是 。
A 降温 B 加压 C 使用催化剂 D 将甲醇从混合体系中分离出来
(14分) 常温下,将某一元酸HA和NaOH溶液等体积混合,两种溶液的浓度和混合后所得溶液的pH如下表:
| 实验编号 | HA物质的量浓度(mol/L) | NaOH物质的量浓度(mol/L) | 混合后溶液的pH |
| 甲 | 0.2 | 0.2 | pH = a |
| 乙 | C1 | 0.2 | pH = 7 |
| 丙 | 0.2 | 0.1 | pH >8 |
| 丁 | 0.1 | 0.1 | pH = 9 |
 _____________________________________。
_____________________________________。中央电视台新闻栏目2006年5月14日报道齐齐哈尔第二制药有限公司生产的假药事件, “齐二药”违反规定,购入工业用“二甘醇”代替医用丙二醇(C3H8O2)作辅料,用于“亮菌甲素注射液”的生产,导致多名患者肾功能衰歇,造成多名患者死亡。二甘醇又称乙二醇醚,分子式为C4H10O3(HO-CH2-CH2-O-CH2-CH2-OH),二甘醇是一种重要的化工原料,可以制取酸、酯、胺等,其主要产品有吗啉及其衍生物1,4-二恶烷(![]() )等被广泛应用于石油化工、橡胶、塑料、制药等行业,用途十分广泛。二甘醇一般的合成路线为:
)等被广泛应用于石油化工、橡胶、塑料、制药等行业,用途十分广泛。二甘醇一般的合成路线为:
![]()
![]() 过程Ⅰ Br2 条件Ⅱ 反应Ⅲ
过程Ⅰ Br2 条件Ⅱ 反应Ⅲ
① ② ③ ④
请回答下列问题:
(1)下列关于“丙二醇”和“二甘醇”及“乙二醇”的有关说法正确的是
A.丙二醇是乙二醇的同系物
B.它们具有相同种类和数目的官能团,性质上完全相同
C.“丙二醇”和“二甘醇”在病人体内都能被氧化为草酸
D.分离“丙二醇”和“二甘醇”可采用分液的方法
(2)过程Ⅰ是石油加工中常用步骤,其名称为 。
(3)从物质B到物质C的过程如果条件控制不好会生成物质E,E可用于金属的切割,则为了能得到二甘醇D,物质B到物质C的反应条件是 ,该反应属于 (添反应类型)。写出B可能生成E的化学方程式: 。
(4)物质D是二甘醇,则合成路线中的物质A、B、C的结构简式分别是:
A: B: C:
(5)反应Ⅲ的化学方程式为: 。
(6) 写出二甘醇制备1,4-二恶烷的化学方程式: 。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com