
题目列表(包括答案和解析)
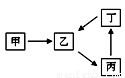
甲、乙、丙、丁四种物质转化关系如右图。已知甲是地壳中含量最高的元素组成的单质,化合物乙、丙、丁均含有第三周期一种相同元素。
(1)若乙是难溶于水的酸性氧化物。
①乙的一种重要用途是 ;
②丙溶液中通入少量CO2生成丁的离子方程式是 。
(2)若2乙(g) + 甲(g) 2丙(g),是工业生产中重要反应之一。
恒容条件下,一定量的乙和甲发生反应,不同温度下乙的转化率如下表所示:
| 温度/℃ | 400 | 450 | 500 | 550 | 600 | 650 |
| 转化率/% | 99.2 | 97.5 | 93.5 | 85.6 | 73.7 | 58.5 |
①该反应的△H 0(填“>”、“<”或“=”,下同);
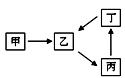
②若400℃和500℃的化学平衡常数分别为K1、K2,则K1 K2。
(3)若丙是离子化合物,且阴离子含金属元素R。
①R的原子结构示意图是 ;
②已知:R(s) + 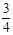 O2(g)=
O2(g)= ![]() R2O3(s) △H=-834.8 kJ·mol -1
R2O3(s) △H=-834.8 kJ·mol -1
Mn(s) + O2(g) = MnO2(s) △H=-520.9 kJ·mol -1
写出R的单质与MnO2反应的热化学方程式 。
甲、乙、丙、丁四种物质转化关系如右图。已知甲是地壳中含量最高的元素组成的单质,化合物乙、丙、丁均含有第三周期一种相同元素。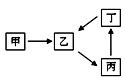
(1)若乙是难溶于水的酸性氧化物。
①乙的一种重要用途是  ;
;
②丙溶液中通入少量CO2生成丁的离子方程式是 。
(2)若2乙(g) + 甲(g)  2丙(g),是工业生产中重要反应之一。
2丙(g),是工业生产中重要反应之一。
恒容条件下,一定量的乙和甲发生反应,不同温度下乙的转化率如下表所示:
| 温度/℃ | 400 | 450 | 500 | 550 | 600 | 650 |
| 转化率/% | 99.2 | 97.5 | 93.5 | 85.6 | 73.7 | 58.5 |
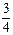 O2(g) =
O2(g) = 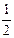 R2O3(s) △H=-834.8 kJ·mol-1
R2O3(s) △H=-834.8 kJ·mol-1甲、乙、丙、丁四种物质转化关系如右图。已知甲是地壳中含量最高的元素组成的单质,化合物乙、丙、丁均含有第三周期一种相同元素。
(1)若乙是难溶于水的酸性氧化物。
①乙的一种重要用途是 ;
②丙溶液中通入少量CO2生成丁的离子方程式是 。
(2)若2乙(g) + 甲(g)  2丙(g),是工业生产中重要反应之一。
2丙(g),是工业生产中重要反应之一。
恒容条件下,一定量的乙和甲发生反应,不同温度下乙的转化率如下表所示:
|
温度/℃ |
400 |
450 |
500 |
550 |
600 |
650 |
|
转化率/% |
99.2 |
97.5 |
93.5 |
85.6 |
73.7 |
58.5 |
①该反应的△H 0(填“>”、“<”或“=”,下同);
②若400℃和500℃的化学平衡常数分别为K1、K2,则K1 K2。
(3)若丙是离子化合物,且阴离子含金属元素R。
①R的原子结构示意图是 ;
②已知:R(s) +  O2(g)
=
O2(g)
= 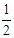 R2O3(s) △H=-834.8 kJ·mol -1
R2O3(s) △H=-834.8 kJ·mol -1
Mn(s) + O2(g) = MnO2(s) △H=-520.9 kJ·mol -1
写出R的单质与MnO2反应的热化学方程式 。
 ;
; 2丙(g),是工业生产中重要反应之一。
2丙(g),是工业生产中重要反应之一。| 温度/℃ | 400 | 450 | 500 | 550 | 600 | 650 |
| 转化率/% | 99.2 | 97.5 | 93.5 | 85.6 | 73.7 | 58.5 |
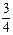 O2(g) =
O2(g) = 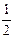 R2O3(s) △H=-834.8 kJ·mol-1
R2O3(s) △H=-834.8 kJ·mol-1(1)经测定,A2D2的水溶液呈弱酸性。请写出第一步的电离方程式。
(2)用甲和单质D2可设计呈燃料电池,若电解质溶液为浓KOH溶液,则正极的电极反应式为______________________________。
(3)
(4)单质F与E的最高价氧化物的水化物的溶液反应的离子方程式是_______________。
(5)常温下向25 mL 0.1 mol·L-1丙溶液中逐滴滴加0.1 mol·L-1丁溶液,滴加过程中混合溶液pH的变化曲线如下图所示:

①图中m点由水电离出的OH-的物质的量浓度为___________________;
②p点时,丙溶液和丁溶液恰好完全反应,则p点溶液中各种离子浓度由大到小的顺序为_____________________。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com