
题目列表(包括答案和解析)
(14分)CuO可用作颜料、玻璃磨光剂、有机合成催化剂等。以下是用铜粉氧化法生产CuO的流程图:

回答下列问题:
(1)写出溶解过程中的离子方程式_____________________________________。
(2)1∶1的H2SO4是用1体积98% H2SO4与1体积水混合而成。配制该硫酸溶液所需的玻璃仪器除玻璃棒外,还需要______________、________________。
(3)该工艺会产生一定量的酸性气体,该气体是______________(写分子式),应加以回收处理。
(4)已知Cu2O是一种碱性氧化物;在酸性溶液中,Cu+的稳定性比Cu2+差
请你设计一个简单的实验检验焙烧后固体(假设只含铜的氧化物)中是否含
Cu2O。 。
(5)不考虑生产中的损耗,要计算铜粉中Cu的含量,需要测定的数据是_______________和________________________(用文字表示)。
(14分)(1)在反应2KMnO4+16HBr===5Br2+2MnBr2+2KBr+8H2O中,还原剂是 。
(2)已知BrFx与H2O按物质的量之比3∶5反应的产物是HF、HBrO3、Br2、O2,该反应中的氧化剂是 ,还原剂是 _,BrFx中的x=____________。
(3)浓盐酸在反应KClO3+HCl―→KCl+ClO2+Cl2+ (补充完整)中显示出来的性质是
_。
(4)在一定条件下,PbO2与Cr3+反应,产物是Cr2O和Pb2+,则与1 mol Cr3+反应所需PbO2的物质的量为 。
(14分)在氯化银的表面负载银纳米颗粒后将具有优秀的光催化性能,可用于光催化降解污水中的有机污染物。某课题组利用如下流程制备这种光催化剂,并同时获取新型净水剂高铁酸钠。
(1)写出①反应的离子方程式______________
(2) 过滤得到氯化银纳米线须洗涤干净后再进行光照。检验氯化银纳米线是否洗净的操作方法是____________________________
(3) 反应②的离子方程式是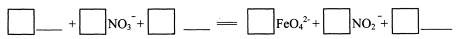
(4) 由21.60g银纳米线得到了25.15g最终产物,则产物中银纳米粒子的质量分数是_______。(计算结果保留两位小数)
(14分)(1)在反应2KMnO4+16HBr===5Br2+2MnBr2+2KBr+8H2O中,还原剂是 。
(2)已知BrFx与H2O按物质的量之比3∶5反应的产物是HF、HBrO3、Br2、O2,该反应中的氧化剂是 ,还原剂是 _,BrFx中的x=____________。
(3)浓盐酸在反应KClO3+HCl―→KCl+ClO2+Cl2+ (补充完整)中显示出来的性质是
_。
(4)在一定条件下,PbO2与Cr3+反应,产物是Cr2O和Pb2+,则与1 mol Cr3+反应所需PbO2的物质的量为 。
(14分)在工业生产和日常生活中有重要用途。 I.工业上用钛矿石(
,含
等杂质)经过下述反应制得:
其中,步骤②发生的反应为:
(1)净化钛矿石时,是否需要除去杂质FeO? ______ (填“需要”或“不需要”)。
(2) 净化钛矿石时,需用浓氢氧化钠溶液来处理,写出该过程中发生反应的化学方程式: __________________
II. TiO2可通过下述两种方法制备金属钛:
“方法一”是电解TiO2来获得Th将处理过的TiO2作阴极,石墨为阳极,熔融CaO为电解液,用碳块作电解槽池。
(3)阴极反应的电极反应式为__________________
“方法二”是先将TiO2与 Cl2、C反应得到TiCl4,再用镁还原得到TL因下述反应难于发生:
所以不能直接由Ti02和Cl2反应(即氯化反应)来制取TiCl4。当往氯化反应体系中加入碳后,碳与上述反应发生耦合,使得反应在高温条件下能顺利进行。
(4) 己知:
请写出与Cl2、C反应制取TiO4的热化学方程式:____________
(5)从化学平衡的角度解释:往氯化反应体系中加入碳时,氯化反应能顺利进行的原因________________________________________________
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com