
题目列表(包括答案和解析)
| ||
| ||
| ||
| ||

 OH+(n-1)H2O
OH+(n-1)H2O OH+(n-1)H2O
OH+(n-1)H2O(1)配平该反应并标出电子转移的方向和数目:KMnO4+HCl = MnCl2+ KCl+ Cl2↑+ H2O
(2)氧化剂是________________,氧化产物是__________________ (填化学式)。
(3)若生成71 g Cl2消耗的HCl是___________________,被氧化的HCl是_______________。
(4)CS2(液体)能在O2中完全燃烧,生成CO2和SO2,若将0.1 mol CS2在1 mol O2中完全燃烧,所得混合气体在标准状况下所占的体积为__________L。
Ⅱ、(6分)(1)下列A. B. C. D 是中学常见的混合物分离或提纯的基本装置
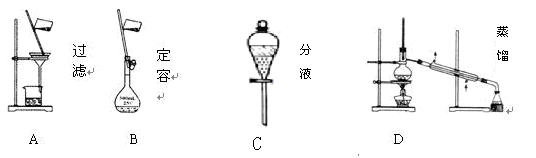
请根据实验需要将A. B.C. D装置填入适当的空格中。
①分离汽油和氯化钠溶液____________________
②用自来水制取蒸馏水__________________
③除去粗盐溶液中悬浮的泥沙_______________________________
(2)检验Fe3+常用的试剂除碱外,还可以将KSCN溶液滴入待检测溶液中,其产生的现象是______
________________________,发生反应的离子方程式________________________________。
某化学反应 3 A ![]() 2 B + D在四种不同条件下进行,B 、D的起始浓度为0。反应物A 的浓度 c 随时间 t 的变化情况如下表:
2 B + D在四种不同条件下进行,B 、D的起始浓度为0。反应物A 的浓度 c 随时间 t 的变化情况如下表:
实验 序号 |
| 0 | 10 | 20 | 30 | 40 | 50 |
1 | 500 | 2.0 | 1.6 | 1.3 | 1.0 | 0.8 | 0.8 |
2 | 500 | C2 | 1.2 | 0.8 | 0.8 | 0.8 | 0.8 |
3 | 500 | C3 | 1.7 | 1.3 | 1.0 | 1.0 | 1.0 |
4 | 600 | 2.0 | 1.1 | 0.9 | 0.9 | 0.9 | 0.9 |
根据上述数据,完成下列填空:
(1)在实验 1 ,反应在10 min ~20 min 内平均速率为_______ mol /(L?min)
(2)在实验 2 ,A 的初始浓度 C2 _______ mol / L ,反应经 20 min 就达到平衡,可推测实验 2 中还隐含的条件是____________________________
(3)设实验 3 的反应速率为 v3,实验 1 的反应速率为 v1,则 v3 ____v1 (填 <、>或=),且C3 ______ 2.0 mol / L (填 <、>或=)
(4)比较实验 4 和实验 1,可推测正反应是______反应(填吸热或放热)。理由是 ______________________
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com