
题目列表(包括答案和解析)
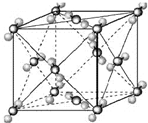 (2009?宿迁模拟)已知A、B、C、D、E都是周期表中前四周期的元素,它们的核电荷数A<B<C<D<E.其中B、D、E原子最外电子层的p能级(轨道)上的电子处于半满状态.通常情况下,A的一种氧化物分子为非极性分子,其晶胞结构如右下图所示.原子序数为31的元素镓(Ga)与元素B形成的一种化合物是继以C单质为代表的第一代半导体材料和GaE为代表的第二代半导体材料之后,在近10年迅速发展起来的第三代新型半导体材料.
(2009?宿迁模拟)已知A、B、C、D、E都是周期表中前四周期的元素,它们的核电荷数A<B<C<D<E.其中B、D、E原子最外电子层的p能级(轨道)上的电子处于半满状态.通常情况下,A的一种氧化物分子为非极性分子,其晶胞结构如右下图所示.原子序数为31的元素镓(Ga)与元素B形成的一种化合物是继以C单质为代表的第一代半导体材料和GaE为代表的第二代半导体材料之后,在近10年迅速发展起来的第三代新型半导体材料.微粒A、B、C为分子,D和F为阳离子,E为阴离子,它们都含有l0个电子;B溶于A后所得的物质可电离出D和E;C是重要的化石能源。将A、B和含F离子的物质混合后可得D和一种白色沉淀。G3+离子与Ar原子的电子层结构相同。请回答:
⑴基态G原子的外围电子排布式是 。在A、B、C这三种分子中,属于非极性分子的有 (写化学式)。
⑵下列有关B的说法中正确的是 。(填字母)
a.在配合物中可作为配体
b.该分子的稳定性与氢键有关
c.分子中各原子最外层均为8e-的稳定结构
d.含1 molB的液体中有3mol氢键
⑶根据等电子体原理,D离子的空间构型是 ,其中心原子轨道的杂化类型是 。
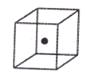
⑷构成C的中心原子可以形成多种单质,其中有一种为空间网状结构,上图立方体中心的“●”表示该晶体中的一个原子,请在该立方体的顶点上用“●”表示出与之紧邻的原子。
⑸光谱证实F与烧碱溶液反应有Na[F(OH)4]生成,则Na[F(OH)4]中不存在 。(填字母)
a.金属键 b.离子键 c.非极性键 d.极性键 f.配位键 g.![]() 键 h.
键 h.![]() 键
键
(15分)微粒A、B、C为分子,D和F为阳离子,E为阴离子,它们都含有l0个电子;B溶于A后所得的物质可电离出D和E;C是重要的化石能源。将A、B和含F离子的物质混合后可得D和一种白色沉淀。G3+离子与Ar原子的电子层结构相同。请回答:
⑴基态G原子的外围电子排布式是 。在A、B、C这三种分子中,属于非极性分子的有 (写化学式)。
⑵下列有关B的说法中正确的是 。(填字母)
a.在配合物中可作为配体
b.该分子的稳定性与氢键有关
c.分子中各原子最外层均为8e-的稳定结构
d.含1 molB的液体中有3mol氢键
⑶根据等电子体原理,D离子的空间构型是 ,其中心原子轨道的杂化类型是 。
⑷构成C的中心原子可以形成多种单质,其中有一种为空间网状结构,上图立方体中心的“●”表示该晶体中的一个原子,请在该立方体的顶点上用“●”表示出与之紧邻的原子。
⑸光谱证实F与烧碱溶液反应有Na[F(OH)4]生成,则Na[F(OH)4]中不存在 。(填字母)
a.金属键 b.离子键 c.非极性键 d.极性键 f.配位键 g.键 h.
键
(15分)微粒A、B、C为分子,D和F为阳离子,E为阴离子,它们都含有l0个电子;B溶于A后所得的物质可电离出D和E;C是重要的化石能源。将A、B和含F离子的物质混合后可得D和一种白色沉淀。G3+离子与Ar原子的电子层结构相同。请回答:
⑴基态G原子的外围电子排布式是 。在A、B、C这三种分子中,属于非极性分子的有 (写化学式)。
⑵下列有关B的说法中正确的是 。(填字母)
a.在配合物中可作为配体
b.该分子的稳定性与氢键有关
c.分子中各原子最外层均为8e-的稳定结构
d.含1 molB的液体中有3mol氢键
⑶根据等电子体原理,D离子的空间构型是 ,其中心原子轨道的杂化类型是 。
⑷构成C的中心原子可以形成多种单质,其中有一种为空间网状结构,上图立方体中心的“●”表示该晶体中的一个原子,请在该立方体的顶点上用“●”表示出与之紧邻的原子。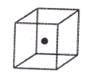
⑸光谱证实F与烧碱溶液反应有Na[F(OH)4]生成,则Na[F(OH)4]中不存在 。(填字母)
a.金属键 b.离子键 c.非极性键 d.极性键 f.配位键 g. 键 h.
键 h. 键
键
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com