
题目列表(包括答案和解析)
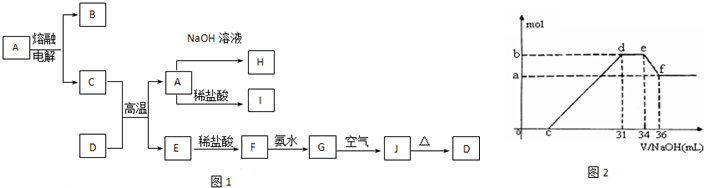

A—J是中学化学中常见的物质,它们之间的转化关系如下框图所示(部分产物已略去)。已知A是一种高熔点物质,J是一种红褐色沉淀。
请回答下列问题:
(1)A的化学式为 ,在水中的溶解性 (选填“易溶”、“可溶”、“难溶”等)。
(2)H溶液中通入过量的CO2,其反应的离子方程式是 。
G→J的化学方程式为 。
反应的现象是 。
(3)D物质恰好溶于一定量的稀盐酸后,用合适的化学用语表示所得溶液显酸性的原因 。
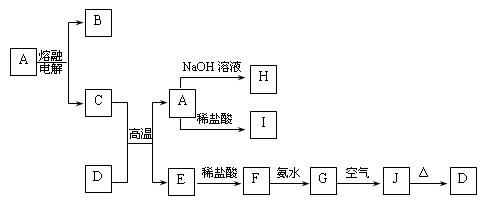
A—J是中学化学中常见的物质,它们之间的转化关系如下框图所示(部分产物已略去)。已知A是一种高熔点物质,J是一种红褐色沉淀。
请回答下列问题:
(1)A的化学式为 ,在水中的溶解性 (选填“易溶”、“可溶”、“难溶”等)。
(2)H溶液中通入过量的CO2,其反应的离子方程式是 。
G→J的化学方程式为 。
反应的现象是 。
(3)D物质恰好溶于一定量的稀盐酸后,用合适的化学用语表示所得溶液显酸性的原因 。
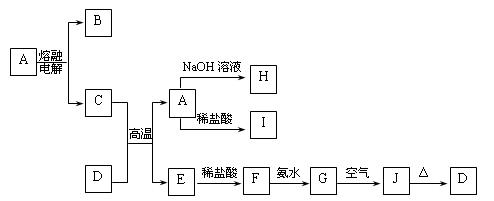
(14分)A—J是中学化学中常见的物质,它们之间的转化关系如下框图所示(部分产物已略去)。已知A是一种高熔点物质,J是一种红褐色沉淀。
请回答下列问题:
(1)A的化学式为 。
(2)H与I溶液混合后,发生反应的离子方程式是 。
G→J的化学方程式为 。
(3)D物质恰好溶于一定量的稀盐酸后,用合适的化学用语表示所得溶液显酸性原因 。
(4) 实验证明,硝酸发生氧化还原反应时,硝酸越稀对应还原产物中氮元素的化合价越低。某同学取一定量的C、E合金与一定量的很稀的硝酸充分反应,反应过程中无气体放出。在反应结束后的溶液中,逐滴加入一定浓度的氢氧化钠溶液,所加氢氧化钠的物质的量与产生的沉淀的物质的量(mol)的关系如左图所示。试回答下列问题:
①图中OC段没有沉淀生成,此阶段发生的离子方程式为:_______________________________。
②在DE段没有沉淀的物质的量没有变化,则此阶段发生反应的离子方程式为:_________________________________;
③B点对应的沉淀量为________________ mol,C点对应的横坐标为___________mol。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com