短周期元素A、B、C、D、E原子序数依次增大。A是周期表中原子半径最小的元素,B是形成化合物种类最多的元素,C是自然界含量最多的元素,D是同周期中金属性最强的元素,E的负一价离子与C的某种氢化物W分子含有相同的电子数。
(1)A、C、D形成的化合物中含有的化学键类型为
;W的电子式
。
(2)已知:①2E → E-E;
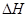
=-a kJ·mol
-1 ② 2A → A-A;
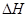
=-b kJ·mol
-1③E+A → A-E;
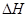
=-c kJ·mol
-1写出298K时,A
2与E
2反应的热化学方程式
。
(3)在某温度下、容积均为2L的三个密闭容器中,按不同方式投入反应物,保持恒温恒容,使之发生反应:2A
2(g)+BC(g)

X(g);
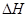
=-a KJ·mol
-1(a>0,X为A、B、C三种元素组成的一种化合物)。初始投料与各容器达到平衡时的有关数据如下:
实验
| 甲
| 乙
| 丙
|
初始投料
| 2 mol A2、1 mol BC
| 1 mol X
| 4 mol A2、2 mol BC
|
平衡时n(X)
| 0.5mol
| n2
| n3
|
反应的能量变化
| 放出Q1kJ
| 吸收Q2kJ
| 放出Q3kJ
|
体系的压强
| P1
| P2
| P3
|
反应物的转化率
| 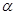 1 1
| 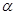 2 2
| 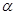 3 3
|
①在该温度下,假设甲容器从反应开始到平衡所需时间为4 min,则A
2的平均反应速率
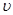
( A
2)为
。
②该温度下此反应的平衡常数K的值为
。
③下列现象能说明甲容器中的反应已经达到平衡状态的有
(填序号)。
A.内A
2、BC、X的物质的量之比为2:1:1
B.内气体的密度保持恒定
C.内A
2气体的体积分数保持恒定
D.2 V
正(A
2)=V
逆(BC)
④三个容器中的反应分别达平衡时各组数据关系正确的是
(填序号)。
A.α
1+α
2=1 B.Q
1+Q
2=a C.α
3<α
1D.P
3<2P
1=2P
2 E.n
2<n
3<1.0mol F.Q
3=2Q
1(4)在其他条件不变的情况下,将甲容器的体系体积压缩到1L,若在第8min达到新的平衡时A
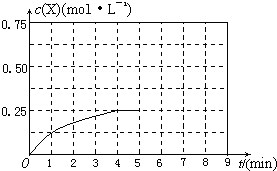
2的总转化率为75%,请在上图中画出第5min 到新平衡时X的物质的量浓度的变化曲线。



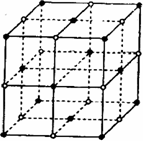
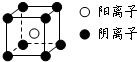 短周期元素A、B、C、D、E、F,原子序数依次增大.已知:①A与E同主族,E的单质与D2反应可生成E2D和E2D2两种固体;②F的单质在D2中燃烧的产物可使品红溶液褪色;B的单质在D2中燃烧可生成BD和BD2两种气体;③CA4++DA-=CA3↑+A2D,各种反应和生成物的电子数都与E+相等.请回答下列问题:
短周期元素A、B、C、D、E、F,原子序数依次增大.已知:①A与E同主族,E的单质与D2反应可生成E2D和E2D2两种固体;②F的单质在D2中燃烧的产物可使品红溶液褪色;B的单质在D2中燃烧可生成BD和BD2两种气体;③CA4++DA-=CA3↑+A2D,各种反应和生成物的电子数都与E+相等.请回答下列问题:



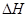 =-a kJ·mol-1 ② 2A → A-A;
=-a kJ·mol-1 ② 2A → A-A;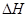 =-b kJ·mol-1
=-b kJ·mol-1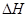 =-c kJ·mol-1
=-c kJ·mol-1 X(g);
X(g);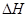 =-a KJ·mol-1(a>0,X为A、B、C三种元素组成的一种化合物)。初始投料与各容器达到平衡时的有关数据如下:
=-a KJ·mol-1(a>0,X为A、B、C三种元素组成的一种化合物)。初始投料与各容器达到平衡时的有关数据如下: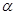 1
1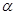 2
2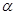 3
3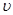 ( A2)为 。
( A2)为 。