
题目列表(包括答案和解析)
元素编号 元素性质 | ① | ② | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ | |
原子半径(10-10 m) | 0.74 | 1.60 | 1.52 | 1.10 | 0.99 | 1.86 | 0.75 | 0.82 | |
主要化合价 | 最高价 |
| 2 | +1 | +5 | +7 | +1 | +5 | +3 |
最低价 | -2 |
|
| -3 | -1 |
| -3 |
| |
试完成下列各题:
(1)上述元素中处于同一主族的有(用编号填空)__________。
(2)硫原子半径[用r(S)表示]的最小取值范围是__________,元素④在周期表中的位置为__________。
(3)元素①、⑥形成的一种较稳定的化合物与水反应的离子方程式为__________________。
(4)元素①形成的氢化物有两种,其中含氢量较高的一种氢化物比含氢量较低的一种氢化物的沸点明显低,其可能原因是____________________________________________________。
(5)元素⑧的单质的基本结构单元为如图1-2-5所示的正二十面体空间构型,其中有20个等边三角形的面和一定数目的顶点,每个顶点各有一个原子。此基本结构单元是由_______个原子构成。
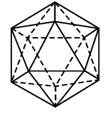
图1-2-5
. |
| v |
| t℃ | 700 | 800 | 830 | 1000 | 1200 |
| K | 0.6 | 0.9 | 1.0 | 1.7 | 2.6 |
在T℃条件下,向1L固定体积的密闭容器M中加入2 mol X和1 mol Y,发生如下反应: 2X(g) + Y(g)  a Z(g) + W(g) △H = -Q kJ·mol-1 (Q>0)
a Z(g) + W(g) △H = -Q kJ·mol-1 (Q>0)
当反应达到平衡后,反应放出的热量为Q1 kJ,物质X的转化率为α;若平衡后再升高温度,混合气体的平均相对分子质量减小,则
(1)化学计量数a的值为 。
(2)写出该反应平衡常数K的表达式 (a必须用具体的值表示)。
(3)下列说法中能说明该反应达到了化学平衡状态的是 。
A:容器内压强一定 B:容器内气体的密度一定
C:容器内Z分子数一定 D:容器内气体的质量一定
(4)X的转化率α= (用含Q、Q1的代数式表示)。
(5)维持温度不变,若起始时向容器中加入的物质的量如下列各项,则反应达到平衡后放出的热量仍为Q1 kJ的是 (稀有气体不参与反应)。
A.2 molX、1mol Y、1molAr
B.a molZ、1mol W
C.1 molX、0.5mol Y、0.5a molZ、0.5 mol W
D.2 molX、1mol Y、1molZ
(6)维持温度不变,若起始时向容器中加入4mol X和6 mol Y,若达平衡时容器内的压强减小了10%,则反应中放出的热量为 kJ。
已知:该反应的平衡常数随温度的变化如下表:
| 温度/℃ | 200 | 250 | 300 | 350 |
| 平衡常数K | 9.94 | 5.2 | 1 | 0.5 |
| | n(X) | n(Y) | n(Z) | n(W) |
| A | 1 | 5 | 2 | 3 |
| B | 2 | 2 | 1 | 1 |
| C | 3 | 3 | 0 | 6 |
| D | 0.5 | 2 | 1 | 1 |
| E | 1 | 0.3 | 2 | 2 |
在T℃条件下,向1L固定体积的密闭容器M中加入2 mol X和1 mol Y,发生如下反应: 2X(g) + Y(g) a Z(g) + W(g) △H = -Q kJ·mol-1 (Q>0)
当反应达到平衡后,反应放出的热量为Q1 kJ,物质X的转化率为α;若平衡后再升高温度,混合气体的平均相对分子质量减小,则
(1)化学计量数a的值为 。
(2)写出该反应平衡常数K的表达式 (a必须用具体的值表示)。
(3)下列说法中能说明该反应达到了化学平衡状态的是 。
A:容器内压强一定 B:容器内气体的密度一定
C:容器内Z分子数一定 D:容器内气体的质量一定
(4)X的转化率α= (用含Q、Q1的代数式表示)。
(5)维持温度不变,若起始时向容器中加入的物质的量如下列各项,则反应达到平衡后放出的热量仍为Q1 kJ的是 (稀有气体不参与反应)。
A.2 molX、1mol Y、1molAr
B.a molZ、1mol W
C.1 molX、0.5mol Y、0.5a molZ、0.5 mol W
D.2 molX、1mol Y、1molZ
(6)维持温度不变,若起始时向容器中加入4mol X和6 mol Y,若达平衡时容器内的压强减小了10%,则反应中放出的热量为 kJ。
已知:该反应的平衡常数随温度的变化如下表:
| 温度/℃ | 200 | 250 | 300 | 350 |
| 平衡常数K | 9.94 | 5.2 | 1 | 0.5 |
试回答下列问题
(7)在300℃发生上述反应,以表中的物质的量投入到相同的恒容反应器中,其中向正反应方向转化的有 (选填 A.B.C.D.E)。
|
| n(X) | n(Y) | n(Z) | n(W) |
| A | 1 | 5 | 2 | 3 |
| B | 2 | 2 | 1 | 1 |
| C | 3 | 3 | 0 | 6 |
| D | 0.5 | 2 | 1 | 1 |
| E | 1 | 0.3 | 2 | 2 |
(8)若在某温度下,2 mol X和1 mol Y在该容器中反应达平衡, X的平衡转化率为50%,则该温度为 ℃。
(9)在(8)小题达平衡后,保持温度和容器体积不变,分别向容器中再加入 A.2 mol X和1 mol Y, B.1molZ和1 mol W, C.1molX , D.1 mol W至新平衡,则和原平衡相比,X的转化率A 、B 、C 、D 。(选填增大,减小,不变)
(10)维持T℃条件不变,若在一个和原容器体积相等的恒压容器N 中,加入2 mol X和1 molY发生如上反应并达平衡,则 (选填M或N)容器中的反应先达到平衡状态,容器中X的质量分数M N(选填>、<、=符号)。
在T℃条件下,向1L固定体积的密闭容器M中加入2 mol X和1 mol Y,发生如下反应: 2X(g) + Y(g) ![]() a Z(g) + W(g) △H = -Q kJ·mol-1 (Q>0)
a Z(g) + W(g) △H = -Q kJ·mol-1 (Q>0)
当反应达到平衡后,反应放出的热量为Q1 kJ,物质X的转化率为α;若平衡后再升高温度,混合气体的平均相对分子质量减小,则
(1)化学计量数a的值为 。
(2)写出该反应平衡常数K的表达式 (a必须用具体的值表示)。
(3)下列说法中能说明该反应达到了化学平衡状态的是 。
A:容器内压强一定 B:容器内气体的密度一定
C:容器内Z分子数一定 D:容器内气体的质量一定
(4)X的转化率α= (用含Q、Q1的代数式表示)。
(5)维持温度不变,若起始时向容器中加入的物质的量如下列各项,则反应达到平衡后放出的热量仍为Q1 kJ的是 (稀有气体不参与反应)。
A.2 molX、1mol Y、1molAr
B.a molZ、1mol W
C.1 molX、0.5mol Y、0.5a molZ、0.5 mol W
D.2 molX、1mol Y、1molZ
(6)维持温度不变,若起始时向容器中加入4mol X和6 mol Y,若达平衡时容器内的压强减小了10%,则反应中放出的热量为 kJ。
已知:该反应的平衡常数随温度的变化如下表:
| 温度/℃ | 200 | 250 | 300 | 350 |
| 平衡常数K | 9.94 | 5.2 | 1 | 0.5 |
试回答下列问题
(7)在300℃发生上述反应,以表中的物质的量投入到相同的恒容反应器中,其中向正反应方向转化的有 (选填 A.B.C.D.E)。
| n(X) | n(Y) | n(Z) | n(W) | |
| A | 1 | 5 | 2 | 3 |
| B | 2 | 2 | 1 | 1 |
| C | 3 | 3 | 0 | 6 |
| D | 0.5 | 2 | 1 | 1 |
| E | 1 | 0.3 | 2 | 2 |
(8)若在某温度下,2 mol X和1 mol Y在该容器中反应达平衡, X的平衡转化率为50%,则该温度为 ℃。
(9)在(8)小题达平衡后,保持温度和容器体积不变,分别向容器中再加入 A.2 mol X和1 mol Y, B.1mol Z和1 mol W, C.1molX , D.1 mol W至新平衡,则和原平衡相比,X的转化率A 、B 、C 、D 。(选填增大,减小,不变)
(10)维持T℃条件不变,若在一个和原容器体积相等的恒压容器N 中,加入2 mol X和1 mol Y发生如上反应并达平衡,则 (选填M或N)容器中的反应先达到平衡状态,容器中X的质量分数M N(选填>、<、=符号)。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com