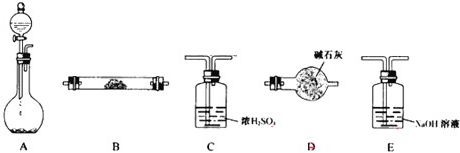
如图所示装置是用于气体制备、干燥、性质验证、尾气处理的部分仪器装置(加热及夹持固定装置均已略去).请根据下列要求回答问题.
(1)若烧瓶中盛装Na
2O
2,分液漏斗中盛装浓氨水,则:
①烧瓶内除了能产生O
2外,还能产生大量NH
3.能产生大量NH
3的原因是:
a.Na
2O
2与水反应,使溶剂减少,降低NH
3的溶解量,使氨气逸出;
b.Na
2O
2与水反应,放热,使氨气逸出;
c.
Na2O2与水反应生成OH-,c(OH-)增大,抑制NH3?H2O的电离,有利于NH3的逸出
Na2O2与水反应生成OH-,c(OH-)增大,抑制NH3?H2O的电离,有利于NH3的逸出
;
②用产生的气体做氨的催化氧化实验,各仪器装置按气流方向(从左到右)连接顺序是:A→
D
D
→
B
B
→
E
E
.
(2)若烧瓶中盛装X g Zn片,分液漏斗中盛装稀H
2SO
4,则:
①当制备H
2、验证H
2还原性并检验H
2的氧化产物,仪器连接顺序A→C→B→B→D时,两次使用B装置,第一个B装置中反应的化学方程式为
、第二个B装置中所盛的药品是
无水CuSO4
无水CuSO4
;D装置的作用是
防止空气中的水进入装置,干扰H2氧化产物的检验
防止空气中的水进入装置,干扰H2氧化产物的检验
.
②上述实验中如果使用的是纯锌,反应速度往往较慢,为了加快H
2产生的速率可采取的方法有
a、c
a、c
a、将烧瓶放入热水中.b、将稀H
2SO
4改为浓H
2SO
4.c、在稀H
2SO
4溶液中滴入少量CuSO
4.d、在稀H
2SO
4中加入少量固体NaCl.
③若锌片不纯(杂质不与稀H
2SO
4反应),稀H
2SO
4及B装置中固体足量,反应后测得第一个B装置质量的变化Y g,则锌片纯度为
.


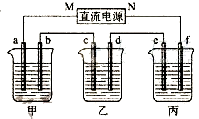 右图所示装置中,甲、乙、丙三个烧杯依次分别盛放100g 5.00%的NaOH溶液、足量的CuSO4溶液和100g 10.00%的K2SO4溶液,电极均为石墨电极.
右图所示装置中,甲、乙、丙三个烧杯依次分别盛放100g 5.00%的NaOH溶液、足量的CuSO4溶液和100g 10.00%的K2SO4溶液,电极均为石墨电极.